
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
【答案】D
【解析】
A、B、C是原子序数依次增大的短周期主族元素,则C原子序数小于17,C的原子序数是A的2倍,所以A的原子序数小于9且A原子序数的2倍大于B的原子序数,结合三种元素原子序数之和为35,可推出:A为O元素、B为Na元素、C为S元素;由如图A、B、C三种元素的单质的变化可得:甲为Na2O或Na2O2,乙为SO2,丙为Na2S。
A项,Na2O、Na2O2、Na2S的水溶液都显碱性,而SO2的水溶液显酸性,故A错误;B项,SO2是酸性氧化物,Na2O是碱性氧化物、Na2O2不是碱性氧化物,故B错误;C项,Na2O2具有漂白性是因为具有强氧化性,而SO2漂白原理是相当于发生化合反应生成了无色物质,所以二者漂白原理不同,故C错误;D项,Na2S溶液在空气中长期放置,会发生反应:2S2-+O2+H2O=2S↓+4OH-,所以溶液会变浑浊,故D正确。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。

①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。

①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:
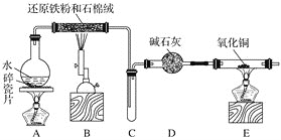
(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯匹林的制备装置和反应原理如下:
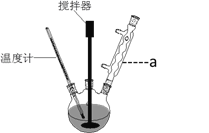
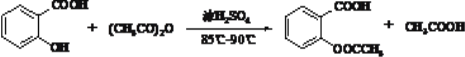
已知乙酸酐(CH3C0)2O在水中会发生水解反应生成乙酸。
实验步骤:
①开启水浴恒温槽的电源,使水浴温度控制在85℃-90℃。
②在三口瓶中加入5g水杨酸,14ml(15g)乙酸酐(CH3C0)2O,1.8ml浓硫酸。
③在水浴中,搅拌反应15min,冷却至室温,在瓶中加入70ml水,继续搅拌5min,再放在冷水浴中静置5—10min,加入冰块,在冰水浴中静置10—20min,冷却结晶,抽滤,用少量冰水洗涤2次。
④将晶体放在250ml烧杯中,并加入70ml饱和碳酸氢钠溶液,搅拌到无二氧化碳放出为止。抽滤除去聚合物固体。
⑤将滤液放在250ml烧杯中,边搅拌边慢慢滴入18%盐酸,直至PH值为1.5。烧杯放入冰水浴中冷却,直至结晶完全。真空抽滤,用少量冰水洗涤二次,得粗产品。
⑥粗产品放入150ml烧杯中,加入20ml无水乙醇,搅拌,缓慢加热,直至晶体溶解,再加入40ml水,在室温中静置,再放入冰水浴中冷却,直至结晶完全。真空抽滤,用少量无水乙醇-水(1:2,v/v)溶液洗涤,烘干,得产品。称量,计算产率。
回答以下问题:
(1)仪器a的名称为_________________
(2)反应容器干燥无水的原因是__________________________________。加入浓硫酸的目的是______________________________________。水浴加热的目的是__________________________
(3)本实验含有两个六元环和一个八元环的副产物的结构简式为__________________。
(4)加入70ml饱和碳酸氢钠溶液的目的是__________________________________。把碳酸氢钠换为氢氧化钠将使产品因________________________而损失。
(5)将滤液边搅拌边慢慢滴入18%盐酸利用了______________________________的原理。
(6)水杨酸可以在各步纯化过程和产物的重结晶过程中被除去,检验水杨酸除尽的方法是____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气放出热量时放出的热量121kJ,且氧气中1 molO=O键完全断裂时吸收热量496kJ,氢气中1mol HH键断裂时吸收热量436kJ,则水蒸气中1mol HO键形成时放出热量为( )
A. 920 kJB. 557 kJC. 221 kJD. 463 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年11月18日射洪撤县设市,于当晚8点的焰火晚会也将庆祝活动推向了高潮。焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是
A.焰色反应实验前铂丝应先用稀硫酸洗涤
B.NaCl与Na2SO4灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.焰色反应属于复杂的化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,其学名、俗名及化学式不相符合的是( )
A.碳酸钠、纯碱、Na2CO3
B.四氧化三铁、磁性氧化铁、Fe3O4
C.氢氧化钠、火碱、NaOH
D.碳酸钙、生石灰、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.形式一:(由粒子数推断)A+、B+、C-、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++ C-→D+E;②B++C-→2D。据此,回答下列问题:写出A+、B+的化学式:____________、____________。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________,B________,E________。
(2)F在元素周期表中的位置为___________________________________。
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______。
(4)元素的非金属性为(原子的得电子能力):E________F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法_________________、___________________(至少2条)。
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________。
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的离子结构示意图________________。
(2)写出元素⑤在周期表中的位置______________。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______。
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为_________。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________周期_______族,它属于_____元素(填“金属”或“非金属”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com