
| A. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 | |
| B. | 氨气具有还原性,可用于检查HCl泄漏 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 |
分析 A.铜离子能使蛋白质变性;
B.氨气与HCl反应生成氯化铵固体;
C.制作耐高温坩埚的材料为高熔点的物质;
D.铁离子具有氧化性,能与Cu反应.
解答 解:A.铜离子能使蛋白质变性,可用来做杀菌剂,与硫酸铜溶于水呈酸性无关,故A错误;
B.氨气与HCl反应生成氯化铵固体,其现象是产生大量的白烟,可用于检查HCl泄漏,与氨气的还原性无关,故B错误;
C.制作耐高温坩埚的材料为高熔点的物质,MgO、Al2O3熔点高,可用于制作耐高温坩埚,故C正确;
D.铁离子具有氧化性,能与Cu反应,所以FeCl3溶液可用于蚀刻印刷电路板,与其酸性无关,故D错误.
故选C.
点评 本题考查了物质间的关系,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | MgCl2 | B. | NaF | C. | MgO | D. | K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3列元素种类最多,第14列元素种类也最多 | |
| B. | 第8、9、10三列元素中没有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
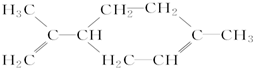
| A. | 柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色 | |
| B. | 柠檬烯分子为非极性分子 | |
| C. | 柠檬烯分子中所有碳原子处于同一个平面上 | |
| D. | 柠檬烯能与酸性高锰酸钾溶液发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com