


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源:2010年江苏省南京市高三上学期期中考试化学试题 题型:实验题
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
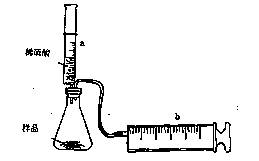 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
|
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
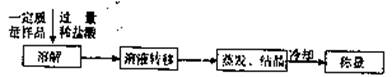
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可以根据电荷守恒,得出x与y的和一定等于m的结论 |
| B.可以根据原子守恒,得出x与m的数值一定相等的结论 |
| C.可以根据氧化还原反应中电子得失守恒,得出x的值等于4的结论 |
| D.可以根据氧化还原反应中各种关系,得出R2+是还原剂,O2是氧化剂,R3+是氧化产物,H2O是还原产物的结论 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省绵阳市涪城区南山中学高一(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com