
| A、Ba(OH)2 |
| B、NaOH |
| C、NH3?H2O |
| D、KOH |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
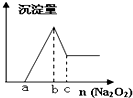 有一透明溶液,可能含有下列离子中的一种或几种,Al3+、Cu2+、Na+、H+、
有一透明溶液,可能含有下列离子中的一种或几种,Al3+、Cu2+、Na+、H+、查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C、马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀 |
| D、镁.铝作电极,与硫酸构成原电池,电流由铝经导线流向镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42- |
| C、能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| D、c(Al3+)=0.5mol?L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气的排放是雾霾形成的重要原因之一 |
| B、运载火箭升空的动力主要来自化学能 |
| C、“玉兔”月球车太阳能电池帆板的材料是二氧化硅 |
| D、玻璃纤维是玻璃钢的增强体,其组成属于无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn+2HCl═ZnCl2+H2↑ | ||||
| B、FeS+2HCl═FeCl2+H2S↑ | ||||
| C、NH3+HCl═NH4Cl | ||||
D、MnO2+4HCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A、Y、W的最简单氢化物的水溶液都呈酸性 |
| B、X、Y与Z中的任意两种元素均可形成两种或两种以上的化合物 |
| C、上述四种元素形成的化合物都抑制水的电离 |
| D、W的单质可从Z的最简单氢化物中置换出Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应的速率越大,化学反应的限度越大 |
| B、化学反应中既有物质变化,又有能量变化 |
| C、化学反应的实质是旧键的断裂,新键的形成 |
| D、可逆反应达到化学平衡状态,反应依然在进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答:
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com