
 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.分析 (1)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,也可判断平衡状态;
(2)根据物质在正逆两个方向转化的量来计算热量进行比较;
(3)根据温度对K的影响,判断是放热还是吸热;
(4)先计算出平衡时各物质的浓度,再求K,根据温度对K的影响,判断A的转化率变化;
(5)平衡常数只与温度有关.
解答 解:(1)a.v(C)=2v(B)不能判断正反应速率和逆反应速率的关系,所以不能说明已经达到平衡状态,故a错误;
b.单位时间内生成2mol A为逆速率,消耗1molB为正速率,而且正逆速率之比等于化学计量数之比,所以是平衡状态,故b正确;
c.反应后气体的物质的量减小,所以容器内的压强减小,所以容器内压强保持不变,即是平衡状态,故c正确;
d.反应后气体的体积不变,气体的质量也不变,所以容器内气体的密度始终保持不变,不能判断平衡状态,故d错误;
故答案为:bc;
(2)2A(g)+B(g)?2C(g)
起始的量:0.50mol 0.25mol 0
转化的量:x 0.5x x
平衡的量:0.50-x 0.25-0.5x x
已知达平衡后测得c(C)=0.40mol.L-1,所以0.40mol.L-1×1L=x,即x=0.4mol;
若在相同的容器中只加入0.50mol C,把C全部转化为AB时,则生成0.50mol A和0.25mol B,与第一次相等,所以两次的平衡为等效平衡,所以平衡时各物质的量相同;
2C(g)?2A(g)+B(g)
起始的量:0.50mol 0 0
转化的量:y y 0.5y
平衡的量:0.50-y y 0.5y
所以0.4=0.50-y,即y=0.1mol,则$\frac{0.4mol}{{Q}_{1}}$=$\frac{0.1mol}{{Q}_{2}}$,所以Q1=4Q2,
故答案为:Q1=4Q2;
(3)K(300℃)>K(350℃),说明升温平衡向逆反应方向移动,所以该反应是放热反应,
故答案为:放;
(4)平衡时c(A)=$\frac{0.50-0.4}{1}$mol/l=0.1mol/L,c(B)=$\frac{0.25-0.5×0.4}{1}$mol/L=0.05mol/L,c(C)=0.40mol/L,所以K=$\frac{{C}^{2}(C)}{{C}^{2}(A)×{C}^{\;}(B)}$=320L•mol-1,反应温度升高,平衡逆移,所以A的转化率减小,
故答案为:320L•mol-1;减小;
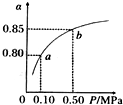
(5)平衡常数只与温度有关,所以平衡状态由a变到b时压强增大,但温度不变,所以K不变,即K(a)=K(b),
故答案为:=.
点评 本题考查了平衡状态的判断,反应放出热量的比较,平衡常数的计算等,题目综合性较强,题目难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | NaOH和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
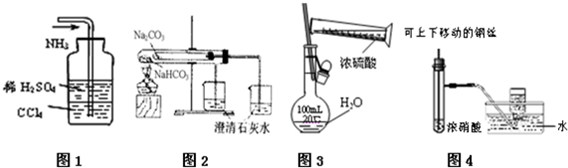
| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液 溴水 | B. | 碳酸钠溶液 溴水 | ||
| C. | 酸性高锰酸钾溶液 溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl2是平面对称型分子 | B. | 分子中C-H,C-Cl键长相等 | ||
| C. | CH2Cl2是非极性分子 | D. | CH4分子中C-H间键角是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p3 | B. | 1s22s22p3 | C. | 1s22s2sp4 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com