
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 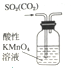 装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. | 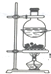 装置,分离NH4Cl和Ca(OH)2固体 | |
| D. | 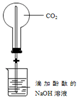 装置,做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若将乙池电解液换成AgNO3溶液,则可以实现在石墨棒上镀银 | |
| B. | 甲池通入CH3OH的电极反应式为CH3OH+6e-+2H2O═CO$\stackrel{2-}{3}$+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗224mL(标准状况下)O2,此时丙池中理论上产生1.16g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列关于“瘦肉精”的说法中正确的是( )
下列关于“瘦肉精”的说法中正确的是( )| A. | 摩尔质量为305.5 | |
| B. | 属于芳香族化合物,也是高分子化合物 | |
| C. | 1mol该有机物在一定条件下可与3 mol氢气发生加成反应 | |
| D. | 向此有机物中加入硝酸酸化的硝酸银溶液会产生淡黄色的沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com