
| A. | v正(N2)=v逆(NH3) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=$\frac{3}{2}$ v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
分析 在一定条件下,可逆反应N2(g)+3H2(g)?2NH3(g) 达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,结合化学计量数与反应速率的关系进行解答.
解答 解:A.表示的是正逆反应速率,但是不满足计量数关系,说明没有达到平衡状态,故A错误;
B.表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故B错误;
C.表示的是正逆反应速率,且满足计量数关系,说明该反应达到了平衡状态,故C正确;
D.N2、H2、NH3的体积比为1:3:2,无法判断各组分的浓度是否不变,无法判断是否达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
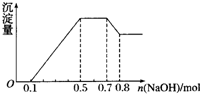 某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.2mol | |
| C. | 溶液中一定不含CO${\;}_{3}^{2-}$,可能含有SO${\;}_{4}^{2-}$和NO${\;}_{3}^{-}$ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度正反应速率加快 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
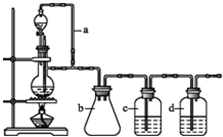 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
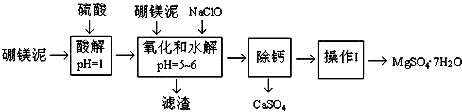
| 温度/℃ | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com