
【题目】下列叙述不正确的是( )
A. IA族与VIIA族元素间可形成共价化合物或离子化合物
B. 共价键只存在于共价化合物中
C. 使阴阳离子结合形成化合物的静电作用,叫做离子键
D. 含有离子键的化合物一定是离子化合物
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种血小板聚集抑制剂,该药物以2-氯苯甲醛为原料的合成路线如下:

请根据以上信息,结合自己的掌握知识和具有的经验回答下列问题:
(1)分子C中除氯原子外的官能团名称为_________。
(2)X的结构简式为____________。
(3)D→E的反应类型是__________反应。
(4)分子C在一定条件下生成一种含有3个六元环的产物的化学方程式_________________
(5)同时满足下列两个条件的B的同分异构体共有____种(不包括B)
①与B含有相同的官能团 ②苯环上的取代基不超过2个。
(6)已知: ![]() 则由乙醇、甲醇为有机原料制备化合物
则由乙醇、甲醇为有机原料制备化合物![]() ,构成需要经历的反应类型有_______ (填写编号)。
,构成需要经历的反应类型有_______ (填写编号)。
①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物![]() 的最后一步反应________________
的最后一步反应________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
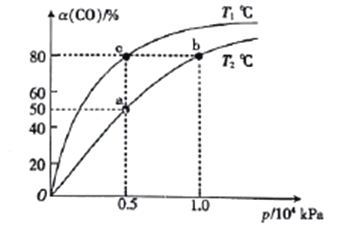
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO
+Ba2++2OH-===BaCO3↓+2H2O+CO![]()
B. 用铁电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO![]() +CO2+H2O===2NaHCO3↓
+CO2+H2O===2NaHCO3↓
D. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3 ·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质说法正确的是
①是浊液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A. ① ⑤⑥ B. ②③④ C.②③⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
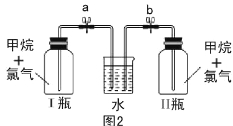
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
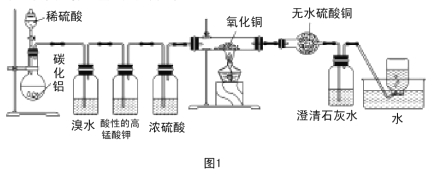
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com