
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是

A.该硫酸的物质的量浓度为9.2mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL
D.该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304L
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)![]() H2O(l) 的ΔH =" 40.69" kJ·mol-1
H2O(l) 的ΔH =" 40.69" kJ·mol-1
B. 已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6
C. 已知:![]() 则可以计算出反应
则可以计算出反应 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
D. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S ![]() TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S* → TiO2/S++e-
I![]() +2e-→ 3I-
+2e-→ 3I-
2TiO2/S++3I-→ 2TiO2/S+I3-
下列关于该电池叙述不正确的是
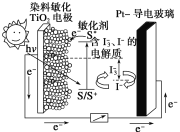
A. 电池工作时,I-在镀铂导电玻璃电极上放电
B. 电池工作时,是将太阳能转化为电能
C. 电池的电解质溶液中I-和I![]() 的浓度不会减少
的浓度不会减少
D. 电池中镀铂导电玻璃为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)为原料制取铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
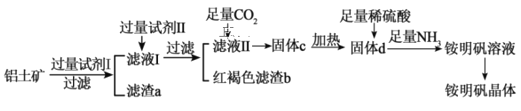
请回答下列问题:
(1)试剂I为__________;试剂Ⅱ为____________;滤渣a的化学式为__________。
(2)证明铁元素已全部转化为滤渣b的实验方法是_______________________________。
(3)滤液Ⅱ中通入足量CO2进行酸化,从而得到固体c,若用盐酸进行酸化是否可以?____,请说明理由:___________________________________________________________。
(4)由固体d制取铵明矾溶液的化学方程式为________________________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)蒸发浓缩、冷却结晶、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
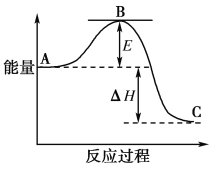
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示______________、________________,E的大小对该反应的反应热________(填“有”或“无”)影响;
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________________________________________________________________;
(3)图中ΔH=________kJ·mol-1;
(4)已知单质硫的燃烧热ΔH=-296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)的ΔH________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法错误的是( )
A. 因为Na比K容易失去电子,所以Na比K的还原性强
B. 第二周期元素从Li到F,非金属性逐渐增强
C. IA族元素Li、Na、K的原子核外电子层数随着核电荷数的增加而增多
D. ⅥA族元素O、S、Se的位置从上至下,故![]() 、
、![]() 、
、![]() 稳定性依次减弱
稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
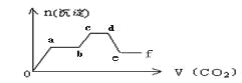
A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下2.2gCO2中含有共用电子对的数目为2NA
B.标准状况下,11.2L乙醇中含的碳原子数为NA
C.25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA
D.6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为:__________________、_______________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是___________,滤渣是________;过滤操作②的滤液是____________和____________,滤渣是_______。
(3)工艺过程中③和④的目的是______________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为__________________;
列式计算该成品的纯度____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com