
 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )| A. | Cl2、I2、IO3-、Fe3+的氧化性依次减小 | |
| B. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2═5I2+2Fe3++12Cl- | |
| C. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=6.5时,溶液中$\frac{n(C{l}^{-})}{n(I{O}_{3}^{-})}$=6.5 | |
| D. | 若溶液的体积不变,则溶液的pH减小 |
分析 由图可知不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-.可见还原性强弱顺序为:I->Fe2+>I2,当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氧化还原反应完毕.
因此,当n(Cl2):n(FeI2)>1:1时,开始生成Fe3+至1.5时,Fe3+达到最大量;
当n(Cl2):n(FeI2)>1.5时,开始生成IO3-,至6.5时,IO3-达到最大量,故折线3的起点若从1.5出发至6.5结束;
当n(Cl2):n(FeI2)<1时,碘离子反应生成碘单质,碘离子浓度减小至1时为0,碘单质的浓度最大,为原来碘离子浓度的一半;
当1.5≥n(Cl2):n(FeI2)>1:1时,Fe2+浓度减少至1.5时,Fe2+达到最小量为0,然后结合发生的离子反应解答.
解答 解:A、原性强弱顺序为:I->Fe2+,所以氧化性Fe3+>I2,故A错误;
B、当n(Cl2):n(FeI2)=1.2时,碘离子全部被氧化,亚铁离子部分氧化,则离子反应为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-,故B正确;
C、当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则n(C1-):n(IO3-)=26:4=13:2=6.5,故C正确;
D、由5Cl2+I2+6H2O=2IO3-+12H++10Cl-可知,随氯气的通入,酸性增强,pH减小,故D正确;
故选A.
点评 本题考查离子反应及氧化还原反应,把握氧化性、还原性强弱确定离子反应的先后顺序为解答的关键,明确每一条折线代表的物质及对应的反应即可解答,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠是氧化剂,水是还原剂 | B. | Na2O2是还原剂,水是氧化剂 | ||
| C. | 过氧化钠既是氧化剂又是还原剂 | D. | 水既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 盐酸 | B. | KHS溶液 | C. | NaOH溶液 | D. | Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
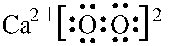 ;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.
;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
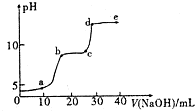 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
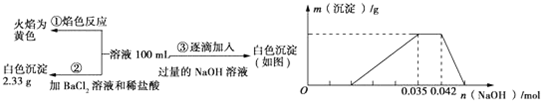
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液只能由等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液混合而成 | |
| B. | 该溶液一定由pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合而成 | |
| C. | 该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g NH3中含有的电子总数为10NA | |
| B. | 常温常压下,14g的C2H4和C3H6混合气体含有的氢原子数为2NA | |
| C. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| D. | 标准状况下,22.4 L 的N2O和CO2混合气体中含有的电子总数为22NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com