
A~H 8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
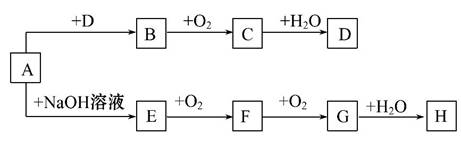
(1)写出下列物质的化学式:A___________。
(2)写出下列反应的化学方程式:
E→F_________________________________________________________;
G→H_________________________________________________________;
D的浓溶液与红热的木炭反应的方程式:____________________________。
(3)检验某溶液中是否含D中阴离子的方法:_________________________。
科目:高中化学 来源: 题型:
铁元素是人体的重要营养元素,铁在人体内的主要功能是参与氧的转运、交换和组织呼吸过程,以及在体内用于生产供给生命活动需要的细胞能量ATP。
(1)人体正常的血红蛋白应该含Fe2+,若误食亚硝酸盐,则导致低铁血红蛋白转化成高铁血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒。下列说法中正确的是 ( )。
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C将Fe3+还原成Fe2+
D.亚硝酸盐被氧化
(2)乳酸可以与精制铁粉制备一种药物,反应式为:
2CH3CH(OH)COOH+Fe―→2[CH3CH(OH)COO]2Fe+H2↑
反应式中的氧化剂是________,还原剂是________,产物乳酸亚铁可以治疗的疾病是________。
(3)举一例说明铁元素在人体中的重要作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
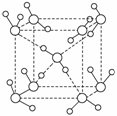
(1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围__________个水分子以氢键结合,晶体中,1 mol水可形成________mol氢键。
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。
OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等离子体的用途十分广泛,运用等离子体束切割金属或者进行外科手术,利用了等离子体的特点是( )
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.K+、Ba2+、OH-、S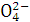 B.Cu2+、N
B.Cu2+、N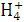 、Br-、OH-
、Br-、OH-
C.H+、N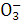 、Fe2+、Na+ D.Ag+、Cl-、Fe2+、K+
、Fe2+、Na+ D.Ag+、Cl-、Fe2+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
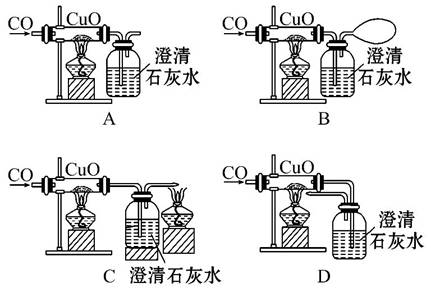
某课外活动小组在学习CO的化学性质时,准备做CO还原CuO的实验。下面是同学们设计的四套实验装置图。从安全和能源充分利用的角度来看,你认为最理想的实验装置是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
在第3周期各元素(稀有气体除外)中,原子半径最大的原子是________,其单质晶
体属于________晶体;原子半径最小的原子是________,其单质晶体属于________晶体,用电子式表示两元素形成化合物的过程:________________________________,该化合物的
晶体属于________晶体,最低负化合价的绝对值等于最高正化合价的原子是________,其单质晶体类型为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子间距离/10-10m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com