
| A. | 石油分馏能得到石油气、汽油和煤油等清洁能源 | |
| B. |  在如图循环转化过程中,太阳能最终转化为热能 | |
| C. | 煤的干馏是指将煤在空气中加热的过程,工业上也叫煤的焦化 | |
| D. | 糖类、油脂、蛋白质是为了人类生命活动提供能量的基本营养物质,都能发生水解反应 |
分析 A、汽油、煤油的燃烧对环境的污染较重;
B、根据图可知,太阳能首先转化为化学能,其次化学能转化为热能;
C、煤在空气中加热会燃烧;
D、糖可以分为单糖、二糖和多糖.
解答 解:A、汽油、煤油中仍然含S元素,燃烧过程中会生成二氧化硫和NOx,对环境的污染较重,不属于清洁燃料,故A错误;
B、根据图可知,太阳能首先转化为化学能,其次化学能转化为热能,即太阳能最终转化为热能,故B正确;
C、煤在空气中加热会燃烧,故煤的干馏是将煤隔绝空气加强热使煤分解的过程,故C错误;
D、糖可以分为单糖、二糖和多糖,二糖和多糖能水解,但单糖不能,故D错误.
故选B.
点评 本题考查了能量转化关系分析、煤和石油的综合利用,看懂能量关系转化图是解决本题的关键,题目难度较小.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2HI$\frac{\underline{\;高温\;}}{\;}$H2+I2 | ||
| C. | H2O+SO2═H2SO3 | D. | Fe2O2+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
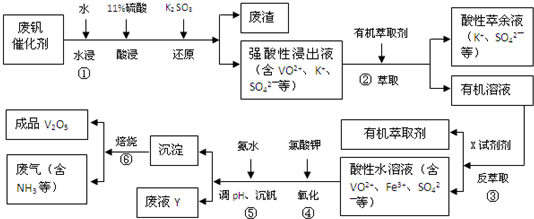
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
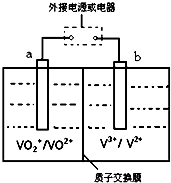
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).
;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2,SiO2,Al2O3均为酸性氧化物 | B. | 稀豆浆,雾,氯化铁溶液均为胶体 | ||
| C. | 漂白粉,水玻璃,氨水均为混合物 | D. | 烧碱,冰醋酸,乙醇均为电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com