
| A. | 与乙烯互为同系物 | |
| B. | 其具有6种同分异构体 | |
| C. | 其一氯代物一共有12种 | |
| D. | 该物质的系统命名的名称为“1-丁烯” |
分析 A.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
B.2-丁烯有顺反异构;
C.与双键相连的碳上的氢原子不发生取代反应;
D.分子式为“C4H8”的物质有多种.
解答 解:A.C4H8可能为环丁烷,不一定是同系物,故A错误;
B.C4H8的结构可能为CH2=CHCH2CH3、CH2=C(CH3)2、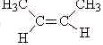 、
、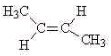 、
、 、
、 ,共有6种同分异构体,故B正确;
,共有6种同分异构体,故B正确;
C.与双键相连的碳上的氢原子不发生取代反应,CH2=CHCH2CH3、CH2=C(CH3)2、 、
、 、
、 、
、 的一氯代物种类分别为2、1、1、1、3、1,共有9种,故C错误;
的一氯代物种类分别为2、1、1、1、3、1,共有9种,故C错误;
D.分子式为“C4H8”的物质有多种,不一定是1-丁烯,故D错误.
故选B.
点评 本题考查同系物、同分异构体的书写,难度较大,注意注意掌握同分异构体书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B | |
| B. | 失电子的能力:C<D | |
| C. | 简单气态氢化物的稳定性:B>E | |
| D. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是新能源家族的重要成员,请解决下列与氢气相关的问题.
氢气是新能源家族的重要成员,请解决下列与氢气相关的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验名称 | 实验操作 | 实验现象 结论 | |
| A | 苯甲酸的重结晶 | ①加热溶解 ②趁热过滤 ③冷却结晶 | 将苯甲酸与溶性杂质分离 |
B | 溴乙烷法制乙烯并验证乙烯 | 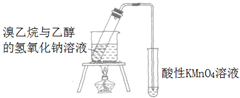 | 现象: KMnO4紫色褪去 结论: 证明有乙烯生成 |
C | 乙醇法制乙烯并验证乙烯 | 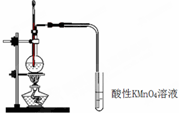 | 现象: KMnO4紫色褪去 结论: 证明有乙烯生 |
D | 验证乙酸、碳酸、苯酚溶液酸性强弱 | 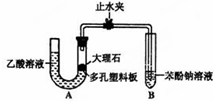 | 现象:A中大理石有气泡,B中溶液变浑浊 结论:酸性 乙酸强于碳酸强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
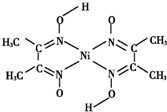 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下: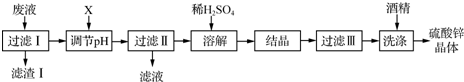
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
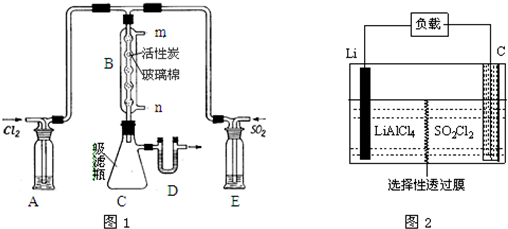
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com