
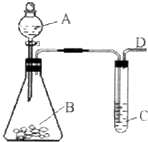
 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 3 |
| 1 |
| 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
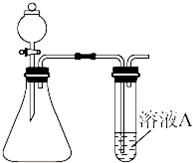 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
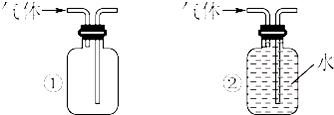
查看答案和解析>>
科目:高中化学 来源:重难点手册 高中化学·必修1 配人教版新课标 人教版新课标 题型:058
某同学用如图所示装置(固定、加热仪器和橡胶管略)进行有关氨制取的实验探究,回答下列问题.
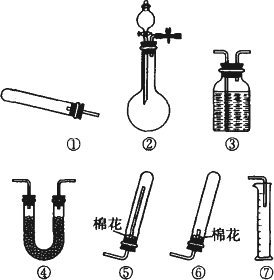
(1)若用装置①制取NH3,其反应的化学方程式为________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是________,分液漏斗中装的试剂是________,收集装置应选择________(填装置序号).证明氨已收集满的操作是________.检验装置②的气密性的方法是________.
(3)若用下列各种试剂组合(其他条件相同)进行制取氨的对比实验,测出氨的体积(标准状况)如下表:
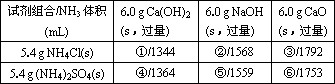
从表中数据分析,实验室制氨的产率最高的是________(填序号).其原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:058
已知漂白粉与浓盐酸在常温下即可反应生成氯气:
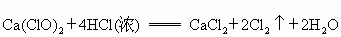
常温下,氯气在水中溶解度较大,但在饱和食盐水中溶解度很小.某同学为了测定产生氯气的体积并验证干燥而纯净的氯气无漂白性,用如图所示的实验装置进行实验.回答下列问题:

(1)请用字母填写装置的连续顺序:a接
( )、( )接( )、( )接( )、
( )接( )、( )接( );
(2)洗气瓶中所装液体是___________________;
(3)在制氯气前,必须进行的一项操作步骤是_______________________;
(4)某同学在实验中发现量筒中未收集到液体,则失败的原因可能是
_____________________________________.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
已知漂白粉与浓盐酸在常温下即可反应生成氯气:
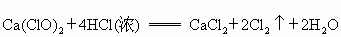
常温下,氯气在水中溶解度较大,但在饱和食盐水中溶解度很小.某同学为了测定产生氯气的体积并验证干燥而纯净的氯气无漂白性,用如图所示的实验装置进行实验.回答下列问题:
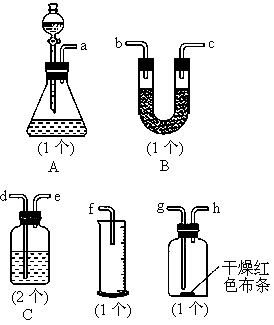
(1)请用字母填写装置的连续顺序:a接
( )、( )接( )、( )接( )、
( )接( )、( )接( );
(2)洗气瓶中所装液体是___________________;
(3)在制氯气前,必须进行的一项操作步骤是_______________________;
(4)某同学在实验中发现量筒中未收集到液体,则失败的原因可能是
_____________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com