
| A. | 2Na+2NH3=2NaNH2+H2↑ | B. | NH3+HCl=NH4Cl | ||
| C. | 4NH3+6NO=5N2+6H2O. | D. | 3SiH4+4NH3=Si3N4+12H2 |
分析 4NH3+5O2→4NO+6H2O反应中氨气中N元素的化合价升高,则氨气作还原剂,根据化合价的变化分析.
解答 解:反应4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O中N元素化合价升高,被氧化,氨气为还原剂,
A.2Na+2NH3→2NaNH2+H2↑反应中,NH3中N元素的化合价不变,H元素化合价降低,氨气为氧化剂,故A错误;
B.HCl+NH3═NH4Cl反应中,没有元素化合价的变化,不是氧化还原反应,故B错误;
C.反应4NH3+6NO=5N2+6H2O中N元素的化合价升高,则氨气作还原剂,故C正确;
D.3SiH4+4NH3=Si3N4+12H2反应中,只有H元素化合价发生变化,氨气中H元素化合价为+1价,SiH4中H为-1价,氨气为氧化剂,故D错误.
故选C.
点评 本题考查了氨气的性质,侧重于氧化还原反应知识应用的考查,注意根据氨气中N元素的化合价变化分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的氯原子个数与被还原的氯原子个数比是1:5 | |
| C. | Cl2既是氧化剂,又是还原剂 | |
| D. | 得电子的氯原子个数与失电子的氯原子个数之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g Na投入到97.7 g水中形成的溶液溶质质量分数为2.3% | |
| B. | 25 g CuSO4•5H2O溶于75 g水之后,溶质的质量分数为16% | |
| C. | Na2O2溶于水后溶质未发生改变 | |
| D. | 6.2 g Na2O溶于水后溶质仍为6.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | (1)图显示M中只有一种溶质且为Na2CO3 | |
| B. | (3)图显示M中有两种溶质且为Na2CO3.NaOH | |
| C. | (2)图显示M中有两种溶质且为Na2CO3.NaHCO3 | |
| D. | (4)图显示M中c(NaHCO3)=c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
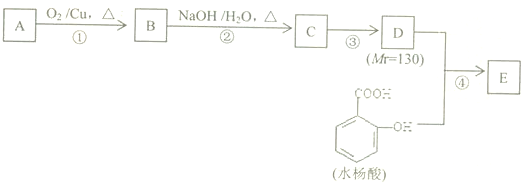
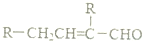
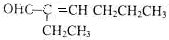 ,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键.
,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn>Cu | B. | Al>Mn | C. | Mn>Mg | D. | Mn>H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入过量铁粉的方法除去Cu(NO3) 2溶液中混有的AgNO3 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中加入BaCl2溶液,以检验未知溶液中是否含有SO42- | |
| D. | 用紫色石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com