
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为14.2克 |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平和药匙 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 转移过程中用玻棒进行引流 |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至凹液面与刻度线相切 |
分析 有关问题:步骤①、根据m=cVM计算配制500mL 0.2mol•L-1Na2SO4溶液,需要硫酸钠的质量;
步骤②:根据称量操作方法判断使用的仪器;
步骤③:通过玻璃棒的搅拌可以加速溶解;
步骤④:将烧杯中溶液移至500ml容量瓶中,为防止溶液溅出,应用玻璃棒引流;
步骤⑤:当水至刻度线1-2厘米处是应改用胶头滴管加水到凹液面与刻度线水平相切;
(1)容量瓶有瓶塞,使用前需要据此容量瓶是否漏液;
(2)根据稀释过程中溶质的物质的量不变计算出钠离子浓度;
(3)加蒸馏水超过刻度线,此次配制失败,需要重新配制;
(4)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$分析操作对所配溶液浓度的影响.
解答 解:步骤①:配制500mL0.2mol•L-1Na2SO4溶液,需要硫酸钠的质量为:0.5L×0.2mol•L-1×142g/mol=14.2g;
步骤②:称量14.2g硫酸钠使用的主要仪器为:托盘天平和药匙;
步骤③:为了加快溶解速率,可用玻璃棒搅拌;
步骤④、将烧杯中溶液移至500ml容量瓶中,为防止溶液溅出,转移中用玻璃棒引流;
步骤⑤、当水至刻度线1-2厘米处是应改用胶头滴管加水到凹液面与刻度线水平相切.
故答案为:
| 实验步骤 | 有关问题 |
| ① | 14.2 |
| ② | 托盘天平和药匙 |
| ③ | 用玻璃棒搅拌 |
| ④ | 转移过程中用玻棒进行引流 |
| ⑤ | 改用胶头滴管加水至凹液面与刻度线相切 |
点评 本题考查了配制一定物质的量的浓度的溶液的方法,题目难度中等,试题侧重基础知识的考查,熟练掌握配制步骤为解答关键,误差分析为难点,需要明确误差分析的方法与技巧.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
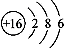 ③Na2O2:
③Na2O2:
 ⑤
⑤ ⑥N2
⑥N2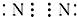
| A. | ①③⑤⑥ | B. | ①③④⑤ | C. | ①⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 mL 1 mol•L-1的氯化钠溶液 | B. | 30 mL 2 mol•L-1的氯化铵溶液 | ||
| C. | 60 mL 3 mol•L-1的氯化钾溶液 | D. | 30 mL 1 mol•L-1的氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度为1 mol/L的CuCl2溶液中,含有Cl- 个数为2NA | |
| B. | 若3.01×1023个X原子的质量为8g,则X3气体的摩尔质量是48g/mol | |
| C. | 用特殊方法把固体物质加工到纳米级(1nm~100nm) 的超细粉末粒子,制得纳米材料,纳米材料也是一种胶体 | |
| D. | 在反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O中,Cl2 既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰中每个水分子平均形成两个氢键 | |
| B. | 冰、“可燃冰”、干冰都具有分子密堆积特征 | |
| C. | 分子晶体中一定不存在单个的原子 | |
| D. | “可燃冰”不属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | HCl═H++Cl- | D. | BaSO4═Ba2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入到水中 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液与盐酸反应:HCO3-+H+═CO2↑+H2 O | |
| C. | 强酸与强碱反应:H++OH-═H2O | |
| D. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com