
(15分)近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 。用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
(15分)
(1)负(2分) SO2+2H2O-2e-=SO42-+4H+ (2分)
利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生。(2分)
(2)①防止亚硫酸铵被氧化(2分) ②ABCD(3分)
③K2SO4在有机溶剂乙二醇中溶解度小,能充分析出(2分)
④4(NH4)2SO3+2NO2=4(NH4)2SO4+N2(2分)
【解析】
试题分析:(1)SO2转化为H2SO4,S元素化合价升高,则SO2失去电子,所以将SO2通入电池的负极;根据化合价的变化配平可得负极电极方程式:SO2+2H2O-2e-=SO42-+4H+;利用自发电池处理SO2,可把化学能转化为电能,可回收大量有效能,通过电池反应生成H2SO4,为副产品,减少环境污染,实现(能质)共生。
(2)①反应出II为二氧化硫与氨水反应生成亚硫酸铵,因为亚硫酸铵具有还原性,容易被氧气氧化,所以加入适量还原性很强的对苯二酚等物质,目的是:防止亚硫酸铵被氧化。
②A、反应Ⅰ为SO2与CaCO3、O2反应生成CaSO4,O2为氧化剂,所以需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙,故A正确;B、根据化学流程,反应物为CaSO4和C,生成物为CaS和CO,配平可得化学方程式:CaSO4+4C CaS+4CO↑,故B正确;C、碳酸氢铵受热易分解,所以反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解,故C正确;D、反应V中的副产物氯化铵含氮元素,可用作氮肥,故D正确。
CaS+4CO↑,故B正确;C、碳酸氢铵受热易分解,所以反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解,故C正确;D、反应V中的副产物氯化铵含氮元素,可用作氮肥,故D正确。
③K2SO4易溶于水,但在有机溶剂乙二醇中溶解度小,能充分析出。
④根据题目所给信息,反应物为(NH4)2SO3与NO2,生成物为氮气和一种氮肥—(NH4)2SO4,配平可得化学方程式:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2。
考点:本题考查化学流程的分析、原电池原理、方程式的书写、氧化还原反应原理。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:2014-2015重庆市高二上学期第二次月考化学试卷(解析版) 题型:填空题
已知A(g)+B(g) 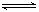 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200 ℃时反应C(g)+D(g) 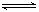 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,下列判断不正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,下列判断不正确的是
A.c1∶c2 =1∶3
B.平衡时,Y和Z生成速率之比为3∶2
C.X、Y的转化率不相等
D.c1的取值范围为0< c1< 0.14 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:填空题
【化学---选修3:物质结构与性质(15分)】“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过 相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为 (填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为 。
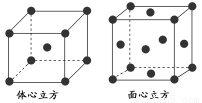
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
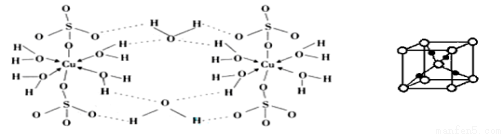
①写出基态Cu2+的核外电子排布式 。
②胆矾中含有的粒子间作用力是 (填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中键的数目为 。胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是
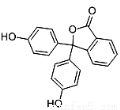
A.分子式为C20H14O4
B.可以发生取代反应、加成反应、氧化反应
C.含有的官能团有羟基、酯基
D.1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为b mol。下列叙述,错误的是
A.溶液中c(H+) =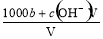
B.物质的量浓度c(HA) =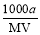 mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =
D.HA的质量分数w(HA) =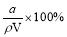
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:简答题
[化学——选修3:物质结构与性质](15分)
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
(2)E2+离子的价层电子轨道表示式是 ,F原子的电子排布式是 ;
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的分子模型为 ;
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
(6)某种化合物由D,E,F三种元素组成,其晶胞 如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:d= g/cm3。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
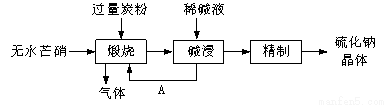
(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x= ,pH控制在 范围。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:选择题
现有CuO和Fe3O4的混合物7.6g,向其中加入1mol/L的H2SO4溶液100 mL恰好完全反应,若将15.2 g该混合物用足量CO还原,充分反应后剩余固体质量为:
A.13.6g B.12g C.6g D.3.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com