
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2 价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
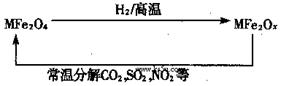
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
【知识点】计算、氧化还原反应 A1 B3 B1
【答案解析】(1)3.5 1:1 (每空2分)
(2)Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O (3分)
解析:(1)根据元素化合价代数和为0知化合物MFe2O4中铁元素的化合价为+3(设Fe的化合价为x,则+2+2x+(-2×4)=0,x=+3),1mol氢气在反应中失去电子2mol,则2mol MFe2O4中的Fe得到电子2mol,即只有2molFe3+得到电子,则MFe2Ox中的2个Fe,1个是+2价,1个是+3价,因此x=3.5,MFe2Ox 中+2价铁与+3价铁的量之比为1:1.
⑵由于Fe2O42-转化为Fe2+是还原反应,因此需加还原剂,即加Cu2O,反应为Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O。
【思路点拨】本题⑵的氧化还原反应的配平:首先根据氧化还原反应得失电子相等配平氧化剂、还原剂、氧化产物和还原产物Fe2O42-+Cu2O=2Fe2++2Cu2+,再根据电荷守恒确定左边加10个H+,最后根据原子守恒配平。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
对于反应①KHCO3溶液与石灰水反应;②Na2SO3溶液与稀盐酸反应;③Si与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量,不能用同一个离子方程式表示的是( )
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质:①Na ②蔗糖 ③NaCl溶液 ④CO2 ⑤盐酸 ⑥熔融KCl ⑦Ba(OH)2晶体
属于电解质的是 ⑥⑦ (填代号,以下同)属于非电解质的是 ,能导电的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
设 NA 为阿伏加德罗常数,下列说法正确的是( )
A、1 mol 氧单质一定含有 2 NA 个氧原子
B、含 4 mol Si—O 键的石英晶体中含氧原子数为 4 NA
C、6.8 g 液态 KHSO4 中含有 0.05 NA 个阳离子
D、1 mol H3O+中含质子数为 10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硅单质及其化合物的说法正确的是
 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素
 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品
 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维
 ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
 A.①② B.②③ C.①④ D.③④
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制造高温结构陶瓷碳化硅(SiC)的化学方程式为SiO2+3C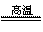 SiC+2CO↑。在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是( )。
SiC+2CO↑。在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是( )。
A.1∶2 B.2∶1 C.1∶l D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,前者属于纯净物,后者属于混合物的是( )
A.净化后的空气;氧化镁
B.水和冰混合;澄清石灰水
C.生锈的铁钉;高锰酸钾充分加热后的剩余固体
D.氯化钾;液氧
查看答案和解析>>
科目:高中化学 来源: 题型:
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是
A.HF、HCl、HBr、HI的热稳定依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次减小
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com