
| A、铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ |
| B、氧化亚铁粉末溶于盐酸中:Fe2O3+6H+=2Fe3++3H2O |
| C、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
| D、向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
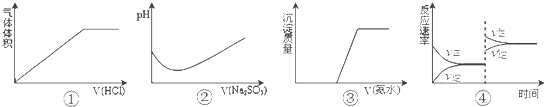
| A、①表示Na2CO3溶液中滴入稀盐酸 |
| B、②表示溴水中滴入Na2SO3溶液 |
| C、③表示AgNO3溶液中滴入氨水 |
| D、④表示一定条件下2SO2+O2?2SO3△H<0达平衡后,升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 |
| B、Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
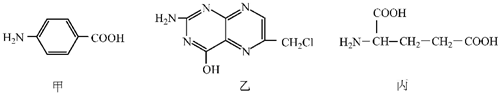
| A、甲的核磁共振氢谱图有4个峰,且峰的面积之比为2:2:2:1 |
| B、乙属于芳香族化合物 |
| C、1mol丙与足量的NaOH溶液或足量Na2CO3溶液充分反应,消耗的NaOH和Na2CO3的物质的量一定不相等 |
| D、丙的系统命名法为1-氨基-1,3-戊二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (SO2)=4mol/(L?min) |
| B、v (SO2)=0.1mol/(L?s) |
| C、v (O2)=3mol/(L?min) |
| D、v (O2)=0.1mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2能与金属活动顺序表中大多数金属反应 |
| B、N2是大气的主要成分之一,雷雨时,可直接转化为NO2 |
| C、硫是一种黄色、能溶于水的晶体,只有氧化性 |
| D、某气体通入澄清石灰水有白色沉淀产生,该气体一定是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质是两性化合物 |
| B、少量的NaCl能促进蛋白质的溶解,浓的NaCl溶液能使蛋白质溶解度降低而从水溶液中析出 |
| C、天然蛋白质水解的最终产物是α氨基酸 |
| D、肽键是蛋白质二级结构中的主键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com