
| A. | 6 | B. | 8 | C. | 11 | D. | 16 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定不含乙烷 | B. | 一定含甲烷,不一定含乙烷 | ||
| C. | 一定含乙烷,不一定含甲烷 | D. | 一定含甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入KSCN溶液无明显现象,再滴加饱和氯水溶液出现血红色,一定有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 同族元素的最外层电子数一定相同 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体元素结束 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| B. | 2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOO-和CN-结合H+能力前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
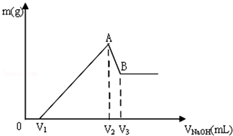 将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:
将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com