
 铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题:
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题:分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,氧化钙和硫化亚铁反应生成硫化钙和氧化亚铁;加入焦炭,先生成CO,最后生成二氧化碳;
(2)根据n=$\frac{m}{M}$计算出1t钢铁的物质的量,根据2Fe2O3+6C+3O2═4Fe+6CO2,可知3O2~4Fe,计算所需的氧气的物质的量,氧气占空气的21%,据此计算需用标况下空气体积;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,氧化钙和硫化亚铁反应生成硫化钙和氧化亚铁,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CaO+FeS$\frac{\underline{\;高温\;}}{\;}$CaS+FeO;CO;
(2)生产1t钢铁的物质的量n=$\frac{m}{M}$=$\frac{1×1{0}^{6}g}{56g/mol}$,由2Fe2O3+6C+3O2═4Fe+6CO2可知3O2~4Fe,则所需的氧气的物质的量为$\frac{1×1{0}^{6}}{56}×\frac{3}{4}$mol,氧气占空气的21%,则需用标况下空气体积为$\frac{\frac{1×1{0}^{6}g}{56g/mol}×\frac{3}{4}×22.4L/mol}{21%}$=1428.6m3,
故答案为:1428.6;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应,则熔融造气炉相当于高炉的炉腹部分,
故答案为:炉腰;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;炉腹;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,
故答案为:用碱液或氢氧化钠、氨水.
点评 本题考查高炉炼铁,侧重于化学与生产的考查,综合考查元素化合物知识,有利于培养学生良好的科学素养,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
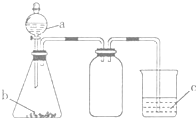 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 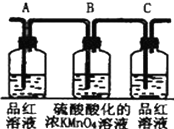 | 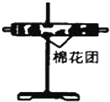 |  |  |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 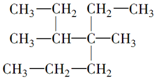 4-甲基-4,5-二乙基乙烷 4-甲基-4,5-二乙基乙烷 | B. | 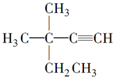 3,3-二甲基-1-戊炔 3,3-二甲基-1-戊炔 | ||
| C. | 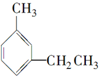 3-甲基乙基苯 3-甲基乙基苯 | D. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,OPA分子中最多有16个原子共平面.
,OPA分子中最多有16个原子共平面.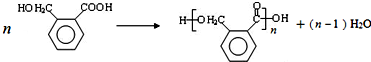 (不必注明反应条件),该反应的类型为缩聚反应.
(不必注明反应条件),该反应的类型为缩聚反应.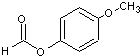 (写出其结构简式).
(写出其结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
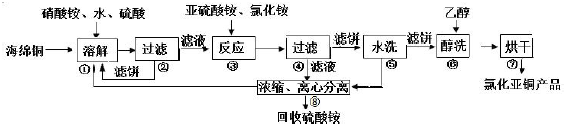
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com