
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的稀H2SO4中,乙同学将电极放入6
mol·L-1的NaOH溶液中,如图所示。
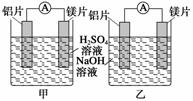
(1)写出甲池中发生的有关电极反应的反应式:
负极_______________________________________________________________,
正极_______________________________________________________________。
(2)写出乙池中发生的有关电极反应的反应式:
负极________________________________________________________________,
正极________________________________________________________________。
总反应离子方程式为__________________________________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
答案 (1)Mg—→Mg2++2e- 2H++2e-—→H2↑
(2)2Al+8OH-—→2[Al(OH)4]-+6e-
6H2O+6e-—→6OH-+3H2↑
2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
(3)Mg Al (4)AD
解析 (1)甲池中电池总反应方程式为Mg+H2SO4===MgSO4+H2↑,Mg作负极,电极反应式为Mg—→Mg2++2e-,Al作正极,电极反应式为2H++2e-—→H2↑。
(2)乙池中电池总反应方程式为2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑,负极上为Al被氧化生成Al3+后与OH-反应生成[Al(OH)4]-,电极反应式为2Al+8OH-—→2[Al(OH)4]-+6e-;正极产物为H2,电极反应式为6H2O+6e-—→6OH-+3H2↑。
(3)甲池中Mg为负极,Al为正极;乙池中Al为负极,Mg为正极,若根据负极材料金属比正极活泼,则甲判断Mg活动性强,乙判断Al活动性强。
(4)选AD。Mg的金属活动性一定比Al强,金属活动性顺序表是正确的,应用广泛。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4: 。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 等玻璃仪器。
(2)步骤1发生反应的离子方程式为
过滤的目的是__________________________________________。
(3)当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
(4)步骤2中溶液的pH控制较难操作,可改用____________________,发生反应的离子方程式为 。
(5)步骤4的操作为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,属于吸热过程的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适合的条件,将反应2Fe3++2I-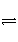
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )

A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
电子表所用纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液。其电极反应是:
Zn+2OH-—→ZnO+H2O+2e-
Ag2O+H2O+2e-—→2Ag+2OH-
总反应式为:Ag2O+Zn===2Ag+ZnO
下列判断正确的是( )
①锌为正极,Ag2O为负极
②锌为负极,Ag2O为正极
③原电池工作时,负极区溶液pH减小
④原电池工作时,负极区溶液pH增大
A.①② B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的Cu(NO3)2溶液,下列说法中正确的是( )
A.阳极发生的电极反应为Cu2++2e-====Cu
B.阴极发生的电极反应为4OH--4e―====2H2O+O2↑
C.若有6.4 g金属Cu析出,放出的O2一定为0.05 mol
D.电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法正确的是( )
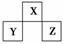
A.原子半径:Z>Y>X
B.若Y的氧化物为两性氧化物,则Z的一种单质在空气中易自燃
C.若X的气态氢化物与Z的最高价氧化物的水化物能反应,则生成的盐仅有一种
D.若Y与Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点前者低于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com