
| A. | 3,4-二甲基-4-己基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,4,4-三甲基己烷 | D. | 2,3,3-三甲基己烷 |
分析 烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;.
解答 解:CH3CH2C(CH3)2CH(C2H5)CH3的最长碳链为6,为饱和烷烃,应命名为己烷,在3号碳上含有2个甲基,在4号碳上含有1个甲基,故正确命名为3,3,4-三甲基己烷,故B正确,故选B.
点评 本题考查了烷烃的命名方法的应用,注意主链选择,位置编号的正确选择.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将铁加到硫酸铜溶液中 Fe+Cu2+=Fe2++Cu | 将钾加到硫酸铜溶液中 2K+Cu2+=2K++Cu |
| B | 向Ca(ClO)2溶液中通入CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 将少量碳酸钙粉末投入到足量的盐酸中 CaCO3+2H+=Ca2++CO2↑+H2O | 将少量碳酸钙粉末投入到足量的硝酸溶液中 CaCO3+2H+=Ca2++CO2↑+H2O |
| D | SO2气体通入BaCl2溶液中,不反应,因为H2SO3的酸性弱于盐酸 | SO2气体通入Ba(NO3)2溶液中也不反应,因为H2SO3的酸性弱于硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳棒作电极电解硫酸铜溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O$\stackrel{通电}{→}$C6H5OH+HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 含有大量NO${\;}_{3}^{-}$的溶液中:NH${\;}_{4}^{+}$、I-、SO42-、H+ | |
| C. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO${\;}_{3}^{-}$、Mg2+ | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、[AI(OH)4]、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能是Si单质 | B. | X可能是含S元素的化合物 | ||
| C. | 酸性氧化物可能为CO2 | D. | 还原性盐可能为FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

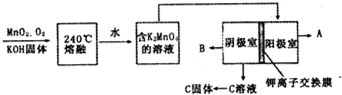
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com