
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 离子半径: X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
【答案】B
【解析】
这几种元素都是短周期元素,根据元素化合价知,X只有-2价,X是O元素、Y只有+1价,Y是Na元素、Z是+3价,Z是Al元素、W有+6价,-2价,W是S元素、R是Cl元素。
A.电子层结构相同的离子,离子半径随着原子序数增大而减小,X、Y、Z离子的电子层结构相同,原子序数X<Y<Z,则离子半径X>Y>Z,故A正确;
B.SO3和水反应形成的化合物是H2SO4,硫酸分子中只含共价键,为共价化合物,故B错误;
C.同一周期元素,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S<Cl,则最高价氧化物对应的水化物酸性:Cl>S,故C正确;
D.Y、Z两者的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,氢氧化铝属于两性氢氧化物,能溶于强酸强碱溶液,NaOH是强碱,所以Y、Z两者的最高价氧化物对应的水化物能相互反应,故D正确;
故选:B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是:
A. 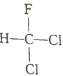 和
和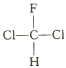 互为同分异构体
互为同分异构体
B. 15g甲基(﹣CH3)含有的电子数是9NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,下列物质在水中的溶解度最大的是
A. C17H35COOH B. CH3COOCH3 C. ![]() D. HOCH2CH(OH)CH2OH
D. HOCH2CH(OH)CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中模拟“侯氏制碱法”,其实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,一段时间后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体,进而生产出纯碱。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接_______,_______接______;b接_______(填接口序号)。
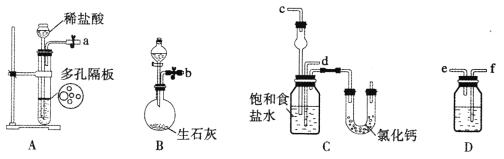
(2)A中常选用的固体反应物为_________;D中应选用的液体为____________。
(3)第二步中让___________装置先发生反应(填装置序号)。
(4)C中用球形干燥管而不用直导管,其作用是____________________;装有无水CaCl2的U形管的作用是__________________________。
(5)第三步分离出NaHCO3固体的操作是__________________________。
(6)第四步中所加固体粉末化学式为___________。所得的晶体中常含有少量的NaCl和NaHCO3(共约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. υ(NH3)=0.0100mol·L-1·s-1B. υ(O2)=0.0010 mol·L-1·s-1
C. υ(NO)=0.0010 mol·L-1·s-1D. υ(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示A、B装置分别探究金属锌与稀硫酸的反应,实验过程中A装置烧杯内的溶液温度升高,B装置的电流计指针发生偏转。

(1)A装置的烧杯中发生反应的离子方程式为________。
(2)B装置中Zn板是________极,Cu板上的现象是________,发生的电极反应式是________。若有1 mol电子流过导线,则正极生成的产物在标准状况下的体积为_______ L。
(3)从能量转化的角度看,A、B中反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量,A中主要是将化学能转化为________,B中主要是将化学能转化为________。
(4)该小组同学反思原电池的原理,其中观点正确的是________(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(5)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则该原电池的负极发生的电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
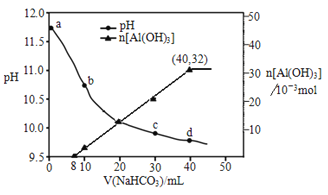
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com