

分析 白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,
(1)锻粉是由白云石高温煅烧而来;CaSO4微溶于水;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;
(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,据此分析;
(5)放电时负极电极本身Al放电,失电子,根据AlCl4-和Al2Cl7-中铝元素和氯元素的比例来确定做AlCl4-做反应物而生成Al2Cl7-.
解答 解:(1)锻粉是由白云石高温煅烧而来,在煅烧白云石时,发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,故所得锻粉主要含MgO和CaO;CaSO4微溶于水,如果用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失,
故答案为:CaO;CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液中的阴离子主要为NO3-,还含有OH-;若滤液Ⅰ中仅通入CO2,会造成CO2过量,则会生成Ca(HCO3)2,从而导致CaCO3产率降低,
故答案为:NO3-,OH-;Ca(HCO3)2;
(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,石墨做阴极,阳极反应为:Al-3e-=Al3+①,阴极上是来自于水的H+放电:2H2O+2e-=2OH-+H2↑ ②
将①×2+②×3可得总反应:2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑,
故答案为:2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑;
(5)放电时负极电极本身Al放电,失电子,由于AlCl4-中氯元素的含量高于Al2Cl7-中氯元素的含量,故AlCl4-做反应物而Al2Cl7-为生成物,由于其它离子不参与电极反应,故电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-,
故答案为:Al-3e-+7AlCl4-=4Al2Cl7-.
点评 本题是一道非常典型的工艺流程图题,综合性较强,综合了元素化合物、电解池和原电池的知识考查,难度较大.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入试剂按①SO42- ②Cl- ③OH-的正确顺序可以将混合液中Cu2+、Ba2+、Ag+逐一沉淀出来加以分离 | |
| B. | 配制480mL 1.0mol•L-1的NaOH溶液时,用托盘天平称取19.2gNaOH固体 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | 用可见光束照射以区别溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
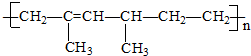
| A. | 2,4-二甲基-2-已烯 | B. | 2,4-二甲基-1,3-已二烯 | ||
| C. | 乙烯和2-甲基-1,3-戊二烯 | D. | 烯和2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理废水中的Cr2O72-的物质的量为nx | |
| B. | 反应中发生转移的电子数为6nxmol | |
| C. | 在FeO•FeyCrxO3中,y=3x=$\frac{3}{2}$ | |
| D. | 消耗硫酸亚铁的物质的量为n(2-x) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 固体2是Fe2O3 | |
| B. | 溶液甲中可能含有Fe3+ | |
| C. | X的化学式可以表示为Fe3C2 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 核外有3种不同原子轨道,每个轨道容纳的电子数相等 |
| C | 基态时,2p轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 是目前生产、生活中应用最广泛的金属 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com