
A、在稀氨水中通入过量CO2:NH3?H2O+CO2=N
| ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | ||||
C、向Ba(OH)2溶液中加入少量的NaHSO3溶液2HS
| ||||
| D、氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌 |
| B、实验室制取氯气时,尾气用碱液吸收 |
| C、金属钠、镁着火时,可用泡沫灭火器来灭火 |
| D、夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾霾天,汽车车灯照出通路的现象属于丁达尔现象 |
| B、冬天烧煤时可在煤中加入生石灰减少二氧化硫的排放 |
| C、防霉霾口罩的原理与过滤、渗折类似,防雾霉效果好的口罩往往呼吸阻力较大 |
| D、PM 2.5是直径小于等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、S2-、OH-、SO42- |
| B、Na+、C6H5O-、CH3COO-、HCO3- |
| C、H+、NH4+、Al3+、SO42- |
| D、K+、SiO32-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温下用焦炭还原SiO2生产硅和一氧化碳属于置换反应 |
| B、BaSO4的水溶液不导电,故BaSO4是弱电解质 |
| C、元素的第一电离能越小,其金属性一定越强 |
D、化合物 可分为醇类、芳香烃类和羧酸类 可分为醇类、芳香烃类和羧酸类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医药中常用酒精消毒是因为酒精能够使细菌蛋白体发生盐析 |
| B、开发清洁能源汽车(如太阳能汽车等)能减少或控制汽车尾气污染 |
| C、目前废旧电池的回收,主要是为了防止电池中NH4Cl对水资源的污染 |
| D、为了防止中秋月饼等富脂食品氧化变质,可在包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、SiO2是还原剂 |
| B、氧化剂与还原剂的质量比为1:2 |
| C、生成1molSi此反应中电子转移4mol |
| D、CO是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它可以发生如下反应:
,它可以发生如下反应:

查看答案和解析>>
科目:高中化学 来源: 题型:
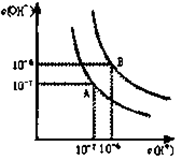 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com