
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
【答案】A
【解析】
A选项,根据Ka2=5.6×10-8得出,![]() ,NaHB溶液中HB-水解程度小于电离程度,溶液显酸性,因此微粒浓度的大小为:c(Na+)>c(HB-) >c(B2-)>c(H2B),故A正确;
,NaHB溶液中HB-水解程度小于电离程度,溶液显酸性,因此微粒浓度的大小为:c(Na+)>c(HB-) >c(B2-)>c(H2B),故A正确;
B选项,酸性H2B > HA > HB-,根据对应酸越弱水解程度越大得出等物质的量浓度的各溶液pH关系为:pH(Na2B) >pH(NaA) >pH(NaHB),故B错误;
C选项,由于酸性H2B > HA > HB-,向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+HA = A-+HB-,故C错误;
D选项,将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,根据电离平衡常数和水解平衡常数得出,电离程度大于水解平衡常数,因此混合液中:c(A-) > c(Na+),故D错误。
综上所述,答案为A。


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】美宇航局(NASA)提醒人类:环保、素食、节能将有效抑制温室效应;否则两极冰山融化,将引发一系列灾难。美国宇航局(NASA)科研人员发现了一种比二氧化碳高104倍的“超级温室气体”全氟丙烷(C3F8),提醒人们慎用含氟物。有关全氟丙烷的说法正确的是
A. 分子中的三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: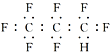
C. 由丙烷转化为全氟丙烷的反应为取代反应
D. 全氟丙烷可由全氟丙烯(CF2=CFCF3)与H2加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验③中的现象为_____;
(3)实验①中反应的离子方程式是_________________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为___。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
Ⅱ.某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+、Cu2+、Fe3+、 Al3+、Fe2+ |
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)③中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将③中红棕色气体(标况下)收集满一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用Na2SO3固体与浓硫酸反应制取SO2,用如图所示装置完成SO2性质性质的探究,请按要求完成填空:
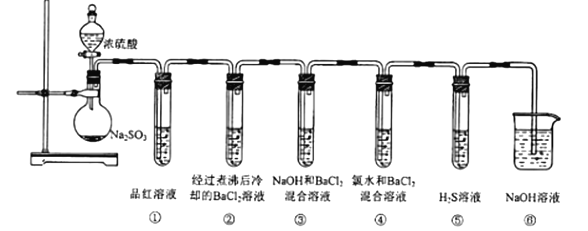
(1)实验中试管①中品红溶液褪色,实验结束后将试管①取下,置于沸水浴中加热,可观察到的实验现象为__。
(2)试管②中无明显现象,而试管③中出现白色沉淀,该沉淀的化学式为___。
(3)试管④中产生白色沉淀,写出其中发生反应的离子方程式:__和___。
(4)试管⑤中出现淡黄色沉淀,证明SO2具有__性。
(5)试管⑥的作用为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法给下列化合物命名:
(1)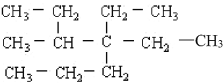 ______________________________
______________________________
(2)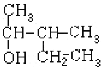 ______________________________
______________________________
(3)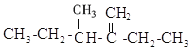 ______________________________
______________________________
(4)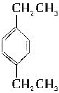 ___________________________
___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
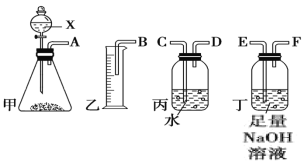
(1)实验室制乙炔的化学反应方程式_____________________________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用________________;
(4)装置丁的作用是____________________
(5)如果乙中收集到水的体积为V mL,电石质量为m g,则电石的纯度为_____________。(体积已换算成标准状况下体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
4NH3(g)+5O2(g)  4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH2=-114.2 kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH3=-71.7kJ/mol
回答下列问题:
(1)NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH=___________kJ/mol。
原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是________。
(2)研究表明2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) ![]() N2O2(g)(快) (b)N2O2(g)+O2(g)
N2O2(g)(快) (b)N2O2(g)+O2(g) ![]() 2NO2(g) (慢)
2NO2(g) (慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的_____(填“大”或“小”)。
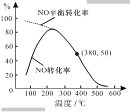
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如右图,则150℃时,v正____v逆(填“>”或“<”)。若起始c(O2)=5.0×104mol·L1,则380℃下反应达平衡时c(O2)=_______ mol·L1。
(3)T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+O2=2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
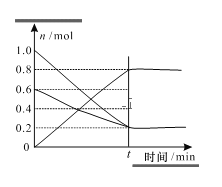
①下列说法能表明该反应已经达到平衡状态的是_______(填序号)
A.混合气体的密度不变
B.混合气体的颜色不变
C.k正、k逆不变
D.2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=___________。
③温度为T1时的化学平衡常数K=_________。若将容器的温度变为T2时k正=k逆,则T2 _______T1(填“>” “<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com