
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
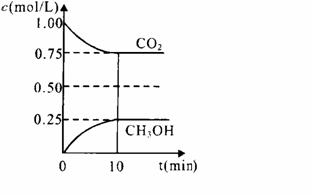
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
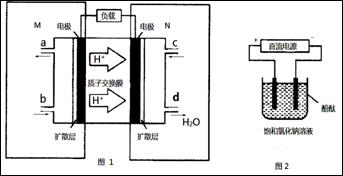
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
科目:高中化学 来源: 题型:
25 ℃时,取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1 C.0.05 mol·L-1 D.0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
现有电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,且已知:CO2+3H2O+2AlO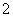 ===2Al(OH)3↓+CO
===2Al(OH)3↓+CO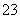 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________________。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是______ __(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是____ ____(填编号)。
(4)将上述①②③④四种电解质溶液混合时,发生反应的离子方程式为____________________________________ _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10﹣16 | 2.2×10﹣20 | 4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说
法错误的是
A. 向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B. 向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C. 该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D. 将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质间的反应与反应类型不相符的是:( )
A.乙烯与溴水(加成反应) B.苯与液溴(取代反应)
C.乙醇与乙酸的酯化反应(取代反应) D.乙醇与氧气(取代反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
A.胆矾、漂白粉、氯化钾、氯气 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.单甘油酯、混甘油酯、苛性钾、石灰石 D.盐酸、水煤气、醋酸、干冰
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池的工作原理:Pb+PbO2+2H2SO4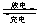 2PbSO4+2H2O;下列判断不正确的是
2PbSO4+2H2O;下列判断不正确的是
A.K 闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为电,d电极为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com