
| A、分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体 |
| B、KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++SO42- |
| C、利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体 |
| D、氯气可用于自来水的消毒 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、0.56L |
| B、0.70L |
| C、0.72L |
| D、0.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取3.3mL蒸馏水 |
| B、用广泛pH试纸测得某溶液的pH为7.2 |
| C、用滴定管量取20.00mL NaOH溶液 |
| D、用电子天平称取2.100g NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、蛋白质、油脂在一定条件下均能发生水解反应 |
| B、在油脂完全皂化后的混合物中加入热的饱和食盐水,搅拌,混合物上下分层,上层是固体肥皂 |
| C、在苯中加入溴水,充分震荡,所得液体显无色 |
| D、分子式是C2H4O2的有机物一定能与碳酸钠反应而放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钾溶液反应 |
| B、氢氧化钡晶体与氯化铵晶体研磨搅拌的反应 |
| C、锌与稀硫酸的反应 |
| D、生石灰变成熟石灰的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+Cl2
| |||
| B、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
C、
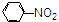 | |||
D、nCH2=CH2
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.| 元素 | Mn | Fe | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com