
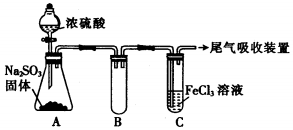
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ① ② ③ |
分析 (1)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性;
(3)Fe3+具有氧化性,可将二氧化硫发生氧化为硫酸根离子;
(4)假设3为在酸性条件下NO3-能氧化SO2,则可用硝酸钡与二氧化硫反应,检验其沉淀是否溶于酸判断为硫酸钡即可.
解答 解:(1)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色;
故答案为:溶液由棕黄色变为浅绿色;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
故答案为:硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
(3)Fe3+具有氧化性,可将二氧化硫发生氧化为硫酸根离子;
故答案为:SO2被Fe3+氧化为SO42-;
(4)假设3为在酸性条件下NO3-能氧化SO2,则可用硝酸钡与二氧化硫反应,检验其沉淀不溶于酸判断为硫酸钡,具体操作为:
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ①取适量Ba(NO3)2溶液于试管中; ②向试管中通入过量SO2气体; ③再向试管中加入过量盐酸. | 若先有白色沉淀生成,加入盐酸后沉淀不消失,则假设3成立. |
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ①取适量Ba(NO3)2溶液于试管中; ②向试管中通入过量SO2气体; ③再向试管中加入过量盐酸. | 若先有白色沉淀生成,加入盐酸后沉淀不消失,则假设3成立. |
点评 本题考查性质实验方案的设计及实验装置综合,为高频考点,题目难度中等,把握装置中发生的反应及氧化还原反应原理的应用为解答的关键,侧重分析与实验能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 溶于水后能形成无色溶液的红棕色气体一定是Br2 | |
| B. | 能使润湿的淀粉碘化钾试纸变蓝的气体一定是Cl2 | |
| C. | 遇空气立即形成红棕色气体的一定是NO | |
| D. | 在潮湿空气中能形成白雾的气体一定是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 肯定含有碳、氢、氧三种元素 | |
| B. | 肯定含有碳、氢元素,可能含有氧元素 | |
| C. | 肯定含有碳、氢元素,不含氧元素 | |
| D. | 该有机物是甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 | |
| B. | 焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 | |
| C. | 一个反应能否自发进行,与焓变和熵变的共同影响有关 | |
| D. | 自发进行的反应一定能迅速进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 14.3% | C. | 48.2% | D. | 87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1克 | B. | 0.2克 | C. | 0.3克 | D. | 0.4克 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中滴入少量氢氧化钠溶液:OH-+HCO3-+Ca2+═CaCO3↓+H2O | |
| B. | 将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 氢氧化钡溶液与硫酸反应:有白色沉淀生成 Ba2++SO42-═BaSO4↓ | |
| D. | 氯气溶解于水:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
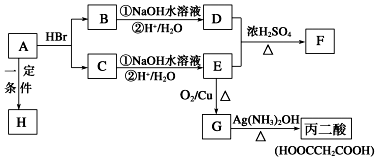 已知A的分子式为C3H4O2,下图是A~H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物.(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)
已知A的分子式为C3H4O2,下图是A~H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物.(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)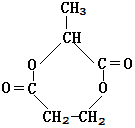
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com