
| A. | b-3 | B. | b+5 | C. | b+4 | D. | b一11 |
分析 短周期元素A、B可形成A3B2型化合物,A的化合价为+2价,B为-3价,A可为Be、Mg,B可为N、P等元素,以此解答该题.
解答 解:短周期元素A、B可形成A3B2型化合物,A的化合价为+2价,B为-3价,A可为Be、Mg,原子序数分别为4、12,B可为N、P等元素,原子序数分别为7、15,形成的化合物可能为Be3N2、Mg3N2、Be3P2、Mg3P2,则若B的原子序数为 b,则A的原子序数可能为b+5、b-11、b-3,
故选C.
点评 本题考查学生利用化合价与化学式及核电荷数的关系,学生应熟悉常见的化合物中的元素的化合价及元素的核电荷数,能利用举例的方法或价序原则来分析解答.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | 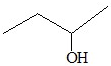 3-丁醇 3-丁醇 | D. | 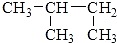 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
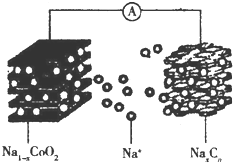 “摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )
“摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,钴的化合价升高 | |
| C. | 充电时,阴极的质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-═Na1-xCoO2+xNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | NaHCO3溶液 | K+、ClO-、AlO2- |
| C | 水电离产生的c(H+)=10-12 mol/L-1的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 逐滴滴加氨水立即有沉淀产生 | Na+、HCO3-、Mg2+、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、NH4+、Br- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 1.0 mol•L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3O+的电子式为 | |
| B. | -NH2的电子式为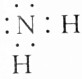 | |
| C. | NaHS显碱性的原因是HS-+H2O?S2-+H3O+ | |
| D. | 乙烷的二氯代物有两种(不考虑立体异构) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com