
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,结合氨气中N元素化合价变化计算转移电子;
(2)由方程式可知,还原得到的N2与氧化得到的N2的物质的量之比为6:4=3:2,设还原得到的N2与氧化得到的N2的物质的量物质的量分别为3xmol、2xmol,则(3x-2x)mol=$\frac{1.4g}{28/mol}$,解得x=0.05,故参加反应的NO为5×0.05mol×$\frac{6}{5}$=0.3mol,参加反应的氨气为5×0.05mol×$\frac{4}{5}$=0.2mol,由于0.3mol+0.2mol=0.5mol<1mol,故NO或NH3有剩余.
解答 解:(1)氨气物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,氨气中N元素化合价由-3价升高为0价,故转移电子为0.2mol×3×6.02×1023mol-1=3.612×1023,
故答案为:3.612×1023;
变化计算转移电子;
(2)由方程式可知,还原得到的N2与氧化得到的N2的物质的量之比为6:4=3:2,设还原得到的N2与氧化得到的N2的物质的量物质的量分别为3xmol、2xmol,则(3x-2x)mol=$\frac{1.4g}{28/mol}$,解得x=0.05,故参加反应的NO为5×0.05mol×$\frac{6}{5}$=0.3mol,参加反应的氨气为5×0.05mol×$\frac{4}{5}$=0.2mol,由于0.3mol+0.2mol=0.5mol<1mol,故NO或NH3有剩余.
若NO有剩余,则NO为1mol-0.2mol=0.8mol,混合物中NO与NH3的物质的量之比为0.8mol:0.2mol=4:1;
若NH3有剩余,则NH3为1mol-0.3mol=0.7mol,混合物中NO与NH3的物质的量之比为0.3mol:0.7mol=3:7,
故答案为:4:1或3:7.
点评 本题考查氧化还原反应以及有关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,关键是根据化学方程式判断还原产物与氧化产物的物质的量的关系.


科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2O<H2S<H2Se | B. | 半径:F->Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 1molCO2和NO2的混合物中含的氧原子数为4NA | |
| C. | 标准状况下,NA个CCl4分子所占的体积约为22.4L | |
| D. | 54g H2O中含有3NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
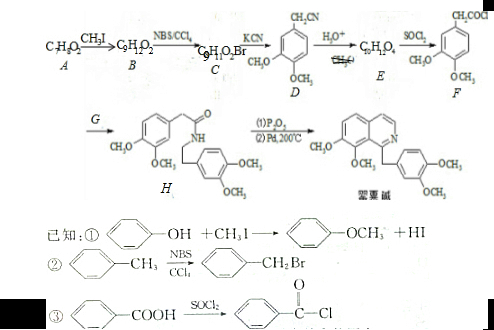
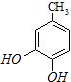 ;C分子中的官能团有醚键和溴原子.(填名称)
;C分子中的官能团有醚键和溴原子.(填名称)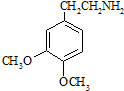 .
.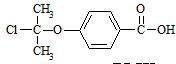 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com