
����Ŀ�����仯��������Ҫ�Ļ���ԭ�ϣ�ijѧϰС���ijЩ��Ļ��������ʺ��Ʊ���������ʵ��̽����
��.̽��ʵ��һ����һ������ŨH2SO4������Zn����װ��A�г�ַ�Ӧ���Է�Ӧ�������X��������ɷַ���(ˮ��������)��

�ش��������⣺
(1)����X�г�ˮ����֮�⣬�������е�������______________________��
(2)B�е��Լ�������__________������KMnO4��Һ��������_____________��
(3)D��Eװ������֤������X�е���һ����֣�����D��Eװ��˳��۲쵽��ʵ������ֱ���___________��___________��
��.̽��ʵ�������ȡ���������(Na2S2O3)��̽�������ʡ�
(1)��ȡNa2S2O3(װ������ͼ���г�װ��ʡ��)��

��װ��B������Na2S2O3��ͬʱҲ����CO2����Ӧ�����ӷ���ʽΪ___________��
�ڳ������ʹ�ö�������⣬��д��һ�ֿ������B������SO2Ч�ʵķ���___________��
(2)̽��Na2S2O3������(��Ӧ������Һ�н���)������գ�
Na2S2O3���� | ʵ����� | ʵ������ | |
̽��1 | Na2S2O3��Һ������� | ____ | pH=8 |
̽��2 | Na2S2O3�Ļ�ԭ�� | �����Ƶ���ˮ�еμ�Na2S2O3��Һ | __________ |
���𰸡������������� Ʒ����Һ(�����Ը�����ء���ˮ) ��ȥ�����в���Ķ������� ��ɫ��ĩ���ɫ ��ɫ��ĩ����ɫ 4SO2+2S2-+CO32-=3S2O32-+CO2 ���ƶ�����������١��ʵ�����B�л��Һ��Ũ�ȡ��ʵ�����B����Һ�¶ȵ� ��С��pH��ֽ���ڱ�������Ƭ���ϣ���պ�д�����Һ�IJ���������pH��ֽ���в�����ֽ��ɫ�������ɫ���Ƚ�ȷ����Һ��pH ��ˮ��ɫ��dz������ˮ��ɫ��
��������
��.��װ��A��Ũ������Zn��Ӧ��������п�����������ˮ������Ӧ���е�һ���̶ȣ�Ũ�����Ϊϡ���ᣬϡ������Zn��Ӧ��������п�����������Է�Ӧ����������X�к���ˮ������SO2��H2��ͨ��Ʒ����Һ�������Ը��������Һ����ˮ�ȣ�����SO2��������KMnO4��Һ��ȥSO2��Ȼ��ͨ��Ũ������Ȼ��ͨ��DʹH2������Ӧ�� CuO+H2![]() Cu+H2O��Ȼ��ͨ����ˮ����ͭ����H2O�Ĵ��ڡ�
Cu+H2O��Ȼ��ͨ����ˮ����ͭ����H2O�Ĵ��ڡ�
��.Ũ������Na2SO3��Ӧ����SO2��SO2��Na2S��Na2CO3������Ӧ����Na2S2O3��CO2��SO2��H2S���Ǵ�����Ⱦ�Ҫ��NaOH��Һ����β��������
��.(1)Ũ������Zn��Ӧ��������п�����������ˮ������Ӧ���е�һ���̶ȣ�Ũ�����Ϊϡ���ᣬZn��ϡ���ᷴӦ��������п����������������X��ˮ��������ܺ���SO2��H2��
(2)װ��B�������Ǽ���SO2��SO2����Ư���ԡ���ԭ�ԣ�����ѡ��Ʒ����Һ�����Ը��������Һ(����ˮ)��Ϊ�����Լ�������H2������֮ǰ��Ӧ����SO2�ĸ��ţ������Ը������������ȥ�����в����SO2��
(3)D��Eװ������֤������X�е�H2��D��H2��ԭ��ɫCuO��ĩΪ��ɫ��Cu���ʣ���Ӧ���ɵ�ˮ����ʢ����ˮ����ͭ��Eװ���У��ῴ����ɫ��ĩ����ͭ���ˮ�õ���ɫ����ͭ���壻
��.(1)��װ��B����A�Ƶõ�SO2��Na2S��Na2CO3��Ӧ����Na2S2O3��ͬʱҲ����CO2������ԭ���غ㡢�����غ㡢����غ㣬�ɵ����ӷ���ʽΪ��4SO2+2S2-+CO32-=3S2O32-+CO2��
�ڿ���SO2�����١��ʵ�����B�л��Һ��Ũ�ȡ��ʵ�����B����Һ�¶ȵȶ��������B������SO2Ч�ʣ�
(2)̽��1����ʵ������pH=8��֪̽��1Ϊ�ⶨNa2S2O3��Һ��pHֵ������Ϊ����һС��pH��ֽ���ڱ�����(����Ƭ)�ϣ���պ�д�����Һ�IJ���������pH��ֽ���в�������ֽ��ɫ�������ɫ���Ƚ�ȷ����Һ��pH��
̽��2����Ҫ�ⶨNa2S2O3��Һ�Ļ�ԭ�ԣ������Һ�м�����ˮ����ˮ�ʳ�ɫ��Na2S2O3��Һ��ɫ�������߷���������ԭ��Ӧ���ῴ��������Ϊ����ˮ��ɫ��dz(����ˮ��ɫ)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ��A�Ǻ���ɫ���壬B�dz�����ǿ�ᣬC�dz�������ɫҺ�塣E��F��Ϊ��ɫ�д̼�����ζ�����壬����E��ʹƷ����Һ��ɫ��G��������Ѫ����I��һ�ְ�ɫ���壬�ڿ��������ձ�ɺ��ɫ����ش��������⣺


��1��F�ĵ���ʽΪ_____��
��2��д����Ӧ�ڵ����ӷ���ʽ�����õ����ű������ת�Ƶķ������Ŀ_____��
��3����ȷ����Ӧ���н�����������ȫ��Ӧ���Լ�Ϊ_____���ѧʽ������Ӧ�۵�װ������ͼ��ʾ������©����������_____��
��4��д����Ӧ�۵����ӷ���ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�о����֣����������������������������Ҫ�ɷ֡��ش��������⣺
(1)�����з�Ӧ����N2(g)+O2(g)=2NO(g) ��H1=+180.5kJ/mol
��C(s)+O2(g)=CO2(g) ��H2=-393.5 kJ/mol
��2C(s)+O(g)=2CO(g) ��H3=-221.0 kJ/mol
��֪ij��Ӧ��ƽ�ⳣ������ʽΪK=![]() ����д���˷�Ӧ���Ȼ�ѧ����ʽ�� _________________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ�� _________________��
(2)��1L�����ܱ������г���һ������NO2�������ֲ�ͬ�����·�����Ӧ��2NO2(g)![]() 2NO(g)+O2(g)��ʵ����NO2��Ũ����ʱ��ı仯���±�(����������N2O4)��
2NO(g)+O2(g)��ʵ����NO2��Ũ����ʱ��ı仯���±�(����������N2O4)��

������˵����ȷ����___________(����ȷѡ������)
A.ʵ��2������ѹǿ��ʵ��1��С
B.��ʵ��2��ʵ��3���жϸ÷�Ӧ�Ƿ��ȷ�Ӧ
C.ʵ��1��ʵ��3��ƽ�ⳣ����
D.ʵ��2ʹ���˱�ʵ��1Ч�ʸ��ߵĴ���
E.��0��10mim��ʵ��2�ķ�Ӧ������(O2)=0.015mol/(L��min)
�ڲ����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����___________(����ȷѡ������)
A.�����ڵ�����ѹǿ���� B.2����(NO2)=����(O2)
C.�����ƽ����Է����������ֲ��� D.NO2��NO��Ũ�ȱȱ��ֲ���
����֪�����ڵ���ʼѹǿΪ P0kPa����800���¶��¸÷�Ӧ��ƽ�ⳣ��Kp=___________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)���ڸ��¶��´ﵽƽ������������м���NO2��NO��2mol��ƽ�⽫___________(����������Ӧ�����ƶ����������淴Ӧ�����ƶ����������ƶ���)��
(3)Ϊ�˼��������е�SO2����ҵβ����SO2���ñ���Na2SO3��Һ���գ��÷�Ӧ�Ļ�ѧ����ʽΪ___________��25��ʱ������1mol/L��Na2SO3��Һ����SO2����ǡ����ȫ��Ӧʱ����Һ��pH___________7(��������������С��������������)����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________(��֪��������H2SO3�ĵ��볣��Ka1=1.3��10-2��Ka2=6.2��10-8)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���͡�ú�͡����;���������ʯ�͵ķ���
B.ú��Һ�����������������仯
C.��ϩ�ͱ�����ʹ���Ը��������Һ��ɫ
D.��Ȳ�ͱ�����ʹ��ˮ��ɫ��ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±������KOH����Һ�м��Ȳ�������ȥ��Ӧ���ǣ� ��
��![]() ��
�� ��(CH3)3CCH2Cl ��CHCl2-CHBr2 ��
��(CH3)3CCH2Cl ��CHCl2-CHBr2 ��![]() ��CH3Cl
��CH3Cl
A.�٢ۢ�B.�ڢۢ�C.ȫ��D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��ӻ�����H�ĺϳ�·�����£�

��֪��i. 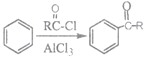
ii. 
�ش���������
(1)A�Ļ�ѧ����Ϊ___________��
(2)B��C�Ļ�ѧ����ʽΪ______________________��
(3)E�Ľṹ��ʽΪ___________����E����F�ķ�Ӧ����Ϊ______________________��
(4)G�й���������Ϊ___________����G��H�Ļ�ѧ����ʽΪ______________________��
(5)�����廯����L��G�Ĺ�������ͬ����L����Է���������GС28�����������������L��ͬ���칹����___________�֡�
����FeCl3��Һ������ɫ��Ӧ ����������3��ȡ����
(6)�� �л��ϳ�·�߿����Ʊ�
�л��ϳ�·�߿����Ʊ� ������������̺���֪��Ϣ������֪M��N�Ľṹ��ʽ�ֱ�Ϊ___________��___________��
������������̺���֪��Ϣ������֪M��N�Ľṹ��ʽ�ֱ�Ϊ___________��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֮�乲��һ��̼ԭ�ӵĻ������Ϊ�ݻ��������[2��2]���飨![]() �������һ�֡����й��ڸû������˵���������
�������һ�֡����й��ڸû������˵���������
A. �뻷��ϩ��Ϊͬ���칹��
B. ���ȴ��ﳬ������
C. ����̼ԭ�Ӿ���ͬһƽ��
D. ����1 molC5H12������Ҫ2 molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298K��1.01��105Pa��O2��S��Se��Te�ֱ���H2���ϵķ�Ӧ��������ͼ��ʾ��д��Se��H2���ϵ��Ȼ�ѧ��Ӧ����ʽ��ȷ����

A. Se(s)+ H2(g) = H2Se(g) ��H=-242kJ��mol-1
B. Se(s)+ H2(g) = H2Se(g) ��H=-20kJ��mol-1
C. Se(g)+ H2(g) = H2Se(g) ��H=+81kJ��mol-1
D. Se(s)+ H2(g) = H2Se(g) ��H=+81kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������ʣ����ۻ���NaOH ��ϡH2SO4��Һ ��KNO3 ���� �ܹ����������ݾƾ�(C2H5OH)��Һ �ɱ�����ش���������(��������)��
�����ڵ���ʵ���______________________��
�����ڷǵ���ʵ���___________________��
��2�������������ǣ��ٱ����6.72L CH4����3.01��1023��HCl����13.6g H2S����0.2mol NH3�����к���ԭ����������_________������������________��(��������)
��3����ͼ��ʾ������I������������ƶ��������¶���ͬ����M�����г���O2��N�����г���SO2��������������������������ȣ���M������N�����������Ϊ___________����M�����г���CO2��N�����г���CO��H2���ֻ�����壬�����岻���ƶ�ʱ�����������Ϊ1:1�� ��M,N������ԭ��������Ϊ___________��
��4������£����_____L��CO���庬��������1.7������������OH- ���ĵ�������ͬ��
��5��9.5 g MCl2�к���Cl-�����ʵ���Ϊ0.2mol,����Ȼ����Ħ������Ϊ________ g/mol�����к�M2+ ������Ϊ______g.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com