
【题目】25℃时,KHS溶液里存在下列平衡:a.HS-+H2O ![]() H3O++S2- b.HS-+H2O
H3O++S2- b.HS-+H2O![]() OH-+H2S。
OH-+H2S。
(1)平衡a是_______平衡(填“电离”或“水解”,下同),平衡b是_______平衡。
(2)向KHS溶液中加入少量NaOH固体,c(S2-)将__________(填“增大”、“减小”或“不变”,下同),向KHS溶被中通入HCl时,c(HS-)将__________。
(3)向KHS溶液中加入CuSO4溶液,有黑色沉淀(CuS)产生,则平衡a__________移动(填“正向”、“逆向”或“不”,下同),平衡b__________移动。
(4)在KHS溶液中,c(OH-)-c(H+)=____________________。
(5)向KHS溶液中加入AlCl3溶液,产生的现象为______________________________。
【答案】电离 水解 增大 减小 正向 逆向 ![]() 生成白色沉淀和具有臭鸡蛋气味的气体
生成白色沉淀和具有臭鸡蛋气味的气体
【解析】
(1)根据方程式可知平衡a中生成水合氢离子,可看成是水加上氢离子;平衡b中生成氢氧根离子,据此分析判断;
(2)依据外界碱或酸对HS-的水解和电离平衡产生的影响作答;
(3)铜离子与硫离子反应会生成黑色的CuS沉淀,据此分析作答;
(4)根据质子守恒规律得出结论;
(5)Al3+与HS-发生双水解。
(1)根据方程式可知平衡a中生成氢离子,是电离平衡,平衡b中生成H2S,是水解平衡,
故答案为:电离;水解;
(2)向KHS溶液中加入氢氧化钠固体时生成硫离子,则c(S2-)将增大,向KHS溶液中通入HCl时生成H2S,则c(HS-)将减小;
故答案为:增大;减小;
(3)向KHS溶液中加入硫酸铜溶液时,有黑色沉淀(CuS)产生,说明平衡向电离的方向进行,则平衡a正向移动,促进电离,平衡b逆向移动,
故答案为:正向;逆向;
(4)在KHS溶液中,遵循质子守恒规律,即![]() ,所以
,所以![]() ,
,
故答案为:![]() ;
;
(5)向KHS溶液中加入AlCl3溶液,发生双水解反应,其离子方程式为:![]() ,所以现象为:生成白色沉淀和具有臭鸡蛋气味的气体,
,所以现象为:生成白色沉淀和具有臭鸡蛋气味的气体,
故答案为:生成白色沉淀和具有臭鸡蛋气味的气体。


科目:高中化学 来源: 题型:
【题目】足量锌与一定量浓H2SO4充分在加热下反应生成会SO2和H2的混合气体。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中含有SO2和H2。取一定量的Zn置于b中,向a中加入100mL 18mol·L-1的浓硫酸,经过一段时间,恰好完全反应。
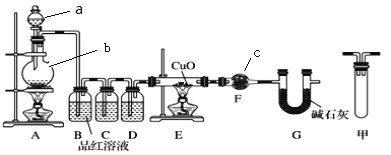
①填写仪器名称:c___________。
②实验开始前应先检验装置的气密性,请回答如何检验装置A的气密性___________。
③用化学方程式表示产生SO2的原因______________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥实验结束后测得装置F增重18.0g,计算实验开始时加入的Zn的质量为________g。你认为实际消耗Zn的质量应比计算值____________。(填“大”、“小”或“相同”)
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
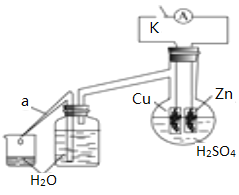
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要化工原料,其制备和有关性质如图所示。
(1)现要用如图所示的浓硫酸来配制步骤①中所需要的1mol/L的稀硫酸480ml,需要用这种浓硫酸的体积为______ml。

(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒、烧杯外还有_______、__________。
(3)下列操作会使所配溶液浓度偏低的是 _________。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度 E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①②③中,途径_________能更好地体现绿色化学的思想。
(5)配制1000ml 0.1mol/L的硫酸铜溶液,需用托盘天平称取________g胆矾。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________,又变为棕黄色的原因是用离子方程式解释___________________________.
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_________。向反应后的溶液中通入过量CO2,反应的离子方程式为______。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________,反应中生成0.2mol HNO3,转移的电子数目为_______。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苹果酸(![]() )的说法正确的是
)的说法正确的是
A. 1mol苹果酸与足量金属Na反应生成1molH2
B. 苹果酸可发生酯化反应,消去反应,缩聚反应
C. 苹果酸能与H2发生加成反应
D. 1mol苹果酸可与3molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间物 ![]() 的合成路线如下:
的合成路线如下:

已知:![]() 。
。
(1)A的系统命名为____________________。
(2)![]() 含有的官能团为______________________________。
含有的官能团为______________________________。
(3)写出③⑥的反应类型分别为__________、__________。
(4)反应④的化学方程式为_____________________________________________。
(5)![]() 的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
①能与FeCl3溶液发生显色反应;②能发生银镜反应。
(6)请设计合理方案用![]() 合成
合成![]() (其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
(其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92gFe和Fe2O3的混合物溶于200mL盐酸中,生成0.336L(标准状况下)氢气,向反应后的溶液中加入KSCN检验,溶液不显红色。为让溶液中的金属离子恰好完全沉淀,消耗了400mL0.750 mol/L的氢氧化钠溶液。则:
(1)产生的氢气中所含的分子数为___。
(2)混合物中Fe和Fe2O3的物质的量之比为___。
(3)盐酸的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
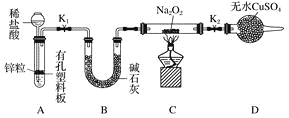
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com