
| A. | 在任何条件下,纯水的pH都等于7 | |
| B. | 在任何条件下,纯水都呈中性 | |
| C. | 在95℃时,纯水的 pH小于7,显酸性 | |
| D. | 在95℃时,纯水中的[H+]小于10-7mol•L-1 |
分析 溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小,如果c(OH+)<c(H+),则溶液呈酸性,如果c(OH+)=c(H+)则溶液呈中性,溶液c(OH+)>c(H+),则溶液呈碱性,据此进行分析.
解答 解:A.水的电离是吸热反应,温度升高,水的离子积增大,若100℃,水的离子积常数是10-12,当pH=6时溶液呈中性,故A错误;
B.纯水中的c(OH+)=c(H+),溶液一定显示中性,故B正确;
C.温度升高,水的电离程度增大,溶液中氢离子浓度增大,溶液pH减小,在95℃时,纯水的pH<7,但是纯水呈中性,故C错误;
D.在95℃时,纯水中的氢离子浓度大于10-7mol/L,故D错误;
故选B.
点评 本题考查了溶液酸碱性的判断,题目难度不大,明确溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小是解本题的关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH-)+c( HC2O4-) | |
| B. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| C. | NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电池中电子由正极流出,经外电路流向负极 | |
| B. | 燃料电池两极板均发生氧化还原反应 | |
| C. | 燃料电池工作时,通常是将空气通向正极 | |
| D. | 化学电池的放电过程就是电能转化为化学能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
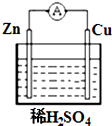 如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:
如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,平衡向逆反应方向移动,c(H+)增大,KW不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
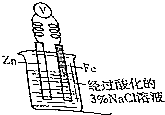 钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com