
����Ŀ����A��B��C��D��E��F��Gԭ���������ε���������Ԫ�أ����Ƕ��Ƕ����ڵ�����Ԫ�أ����У�AԪ��ԭ�ӵİ뾶��С��BԪ�ص���̬�⻯��������ۺ����������һ���Σ�Cԭ��M���������K���һ�룻Fԭ�ӵõ��������Ӻ���Arԭ�Ӻ�������Ų���ͬ��C��E��F������������ˮ���ﶼ������֮�䷢����Ӧ����ش��������⣺
��1��Fԭ�ӵ�ԭ�ӽṹʾ��ͼ�� �� GԪ���γɵĵ��ʵĽṹʽΪ ��
��2���õ���ʽ��ʾA��C�γɵĻ�������γɹ��� ��
��3��B��D��E����ԭ�ӵ�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��Żش� ��
��4�����ۻ�����FG2������ԭ�Ӷ����������8���ӹ��ͣ���д��FG2�ĵ���ʽ ��
��5��д��C��E������������ˮ����֮�䷴Ӧ�����ӷ���ʽ ��
���𰸡�
��1�� ��Cl��Cl
��Cl��Cl
��2��![]()
��3��Mg��Al��N
��4��![]()
��5��Al��OH��3+OH��=AlO2��+2H2O
���������⣺A��B��C��D��E��F��Gԭ���������ε���������Ԫ�أ����Ƕ��Ƕ����ڵ�����Ԫ�أ�AԪ��ԭ�ӵİ뾶��С����AΪHԪ�أ�BԪ�ص���̬�⻯��������ۺ����������һ���Σ���BΪNԪ�أ�Cԭ��M���������K���һ�룬��C���������Ӳ㣬ÿ��������ֱ�Ϊ2��8��1������CΪNaԪ�أ�Fԭ�ӵõ��������Ӻ���Arԭ�Ӻ�������Ų���ͬ����F�ĺ�����16�����ӣ���FΪSԪ�أ�C��E��F������������ˮ���ﶼ������֮�䷢����Ӧ����EΪAlԪ�أ�D��ԭ������С��Al����Na������DΪMgԪ�أ�G��ԭ����������S�Ķ�����Ԫ�أ�����GΪClԪ�أ�����������AΪH��BΪN��CΪNa��DΪMg��EΪAl��FΪS��GΪCl����1��FΪSԪ�أ�ԭ�Ӻ�����16�����ӣ��������Ų�����ԭ�ӽṹʾ��ͼ��  ��GΪClԪ�أ�ClԪ���γɵĵ��ʵĽṹʽΪ Cl��Cl�����Դ��ǣ�
��GΪClԪ�أ�ClԪ���γɵĵ��ʵĽṹʽΪ Cl��Cl�����Դ��ǣ�  ��Cl��Cl����2��A��C�γɵĻ�����ΪNaHS���õ���ʽ��ʾNaHS���γɹ���Ϊ��
��Cl��Cl����2��A��C�γɵĻ�����ΪNaHS���õ���ʽ��ʾNaHS���γɹ���Ϊ�� ![]() ��
��
���Դ��ǣ� ![]() ����3�����Ӳ�Խ��ԭ�Ӱ뾶Խ���Ӳ���ͬ��ԭ�ӣ�ԭ������Խ�뾶ԽС������ԭ�Ӱ뾶��Mg��Al��N��
����3�����Ӳ�Խ��ԭ�Ӱ뾶Խ���Ӳ���ͬ��ԭ�ӣ�ԭ������Խ�뾶ԽС������ԭ�Ӱ뾶��Mg��Al��N��
���Դ��ǣ�Mg��Al��N����4�����ۻ�����SCl2������ԭ�Ӷ����������8���ӹ��ͣ���SCl2�ĵ���ʽΪ ![]() ��
��
���Դ��ǣ� ![]() ����5��CΪNa��EΪAl��Na��Al������������ˮ����֮�䷴Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
����5��CΪNa��EΪAl��Na��Al������������ˮ����֮�䷴Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
���Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϣ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų���ͼ1��ʾ����ͬѧ�����ĵ����Ų�ͼΥ�� �� BԪ��λ�����ڱ���������е���
��ACl2������A���ӻ�����Ϊ �� ACl2�Ŀռ乹��Ϊ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ ��
��д��һ����CN����Ϊ�ȵ�����ĵ��ʵĵ���ʽ ��
���������������[Fe��CN��6]4������� ��
A�����ۼ� B���Ǽ��Լ� C����λ�� D���Ҽ� E���м�
��3��һ��Al��Fe�Ͻ�����徧����ͼ2��ʾ����ݴ˻ش��������⣺
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶ�=�� g/cm3 �� ��˺Ͻ������������Feԭ��֮��ľ��루�ú��ѵĴ���ʽ��ʾ�����ػ���Ϊcm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������⣺ʵ������Ҫ��ȡһƿ���������������������ͼ������ҩƷ�ɹ�ʹ�ã� 
��1��ʵ������ȡ������ԭ����������HCl�����ֵ������� ��
��2������������������ȷ˳���ǣ�����ӿڴ�����ĸ���� �� �� �� �� �� �� ��
��3��������װ���У��ֱ�ʢװ��һЩ��Һ����˵����װ��Һ�����ã�����ʳ��ˮ����������Ũ��������������������Ƶ������� ��
��4��ʢװNaOH��Һ���Լ�ƿ�з����Ļ�ѧ��ӦΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ㶨���ݻ����ֲ���������н��������·�Ӧ��H2��g��+I2��g��2HI��g������˵���÷�Ӧ�Ѵﵽƽ��״̬���ǣ� ��
A.������ ![]()
B.�����ڵ�ѹǿ���ٱ仯
C.����1mol H��H��ͬʱ����2mol H��I
D.��������ɫ���ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壬�����ܱ� �����еķ�Ӧ��N2��g��+3H2��g��2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� �� 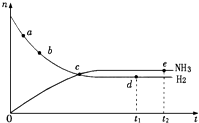
A.��a������Ӧ���ʱȵ�b�Ĵ�
B.��c����Ӧ�ﵽƽ��
C.��d ��t1ʱ�̣��͵�e ��t2ʱ�̣���n ��N2����һ��
D.�����������䣬773K�·�Ӧ��t1ʱ�̣�n��H2����ͼ��d���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��ϡ��˵����ȷ���ǣ� ��
A.��1 L 0.1molL��1��Ba��OH��2��Һ��ˮϡ��Ϊ2L��pH=13
B.pH=3�Ĵ�����Һ��ˮϡ��100����pH=5
C.pH=4��H2SO4��ˮϡ��100������Һ����ˮ���������[H+]=1��10��6molL��1
D.pH=8��NaOH��Һ��ˮϡ��100������pH=6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳ��£�N2H4 �� ��ɫҺ�壩��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
��1���������ӵĵ���ʽΪ �� ���е��Ļ��ϼ�Ϊ ��
��2��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ ��
��3����2O2��g��+N2��g���TN2O4��l����H1
��N2��g��+2H2��g���TN2H4��l����H2
��O2��g��+2H2��g���T2H2O��g����H3
��2N2H4��l��+N2O4��l���T3N2��g��+4H2O��g����H4=��1048.9kJmol��1
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4= �� ������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ ��
��4������Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ƣ�������һ�����뷴Ӧ��ƽ�ⳣ��ֵΪ����֪��N2H4+H+N2H5+��K=8.7��107��Kw=1.0��10��14���������������γɵ���ʽ�εĻ�ѧʽΪ ��
��5��������һ�ֳ��õĻ�ԭ������װ������AgBr���Թ��м���������Һ���۲쵽�������� �� ���������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�������ɳ�ȥˮ���ܽ��O2kg����ʹ��Na2SO3����ˮ���ܽ��O2��ȣ��������ŵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AԪ��ԭ�ӵ�L���BԪ��ԭ�ӵ�L����3�����ӣ�BԪ��ԭ�Ӻ����������AԪ��ԭ�Ӻ������������5������A��B��Ԫ���γɵĻ�����ɱ�ʾΪ�� ��
A.BA2
B.BA3
C.A3B2
D.B3A2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ô��Σ���Ca2+��Mg2+��SO42�������ʣ�Ϊ��Ҫԭ�ϲ��á������Ƽ����������ͻ���NH4Cl��������������ͼ��ʾ�������й�˵����ȷ���� �� �� 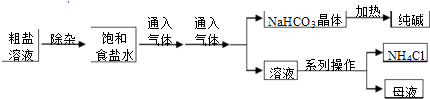
A.�Դ�����Һ���ӿ����μ���NaOH��Na2CO3��BaCl2 �� �ټ������������ҺpH
B.����ʳ��ˮ����ͨ�������ΪCO2
C.����ͼ�е�ϵ�в�����һ����Ҫ������
D.
��ͼ��ʾװ�ÿ��ԱȽ�Na2CO3��NaHCO3��������ȶ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com