
【题目】某温度时,在 2 L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
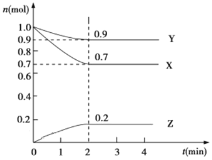
(1)反应从开始至 2 分钟末,Y 的转化率为α(Y)=_______________。
(2)由图中所给数据进行分析,该反应的化学方程式为____________。
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在1L定容的密闭容器中,可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
A. c(N2):c(H2):c(NH3)=1:3:2
B. 一个N≡N 断裂的同时,有3个H-H生成
C. 其他条件不变时,混合气体的密度不再改变
D. v正(N2)═2 v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL-1氨水中加入少量水,pH减小,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着含氮元素不同物质间的转化,实现氮按照一定的方向转化一直是科学领域研究的重要课题。氮气在催化剂作用下的一系列转化如图所示:
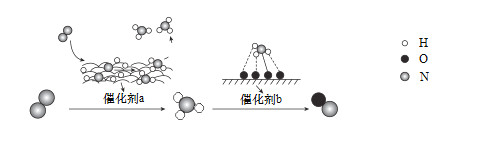
下列叙述正确的是
A.N2转化为NH3、NH3转化为NO均属于氮的固定
B.在催化剂a的作用下,氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.催化剂a、b均可以提高单位时间内反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图 a 是 1 mol NO2 和 1 mol CO 恰好反应生成 CO2 和 NO 过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的 NO2 和 CO,反应中的 CO 和 NO 的浓度随时间变化的示意图如 b 图。根据图意回答下列问题:
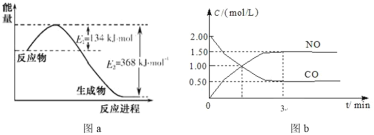
(1)写出 NO2 和CO 反应的热化学方程式__________。
(2)从反应开始到平衡,用 NO2 浓度变化表示平均反应速率 v(NO2)=_________。
(3)此温度下达到平衡时 NO2 的转化率为_________。
(4)830K 时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)CO2(g)+H2(g) △H<0。试回答下列问题:
①若起始时 c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时 CO 的转化率为 60%,则在该温度下,该反应的平衡常数 K=__。
②在相同温度下,若起始时 c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得 H2 的浓度为 0.5mol·L-1,则此时该反应______(填“是”与“否”)达到平衡状态,此时 v(正)_____v(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取4.00g氧化铜和氧化铁固体混合物,加入50.0mL2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_________________。
(2)固体混合物中氧化铜的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g) + O2(g)2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是

A.反应的 ΔH<0
B.过程b 使用了催化剂
C.过程b 发生两步反应,第一步为吸热反应
D.使用催化剂可以降低反应活化能,提高 SO2 的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是( )

A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜由右侧向左侧迁移
B.可用湿润的KI-淀粉试纸检验气体M
C.石墨极的电极反应式为NH4++3Cl--6e-===NCl3+4H+
D.电解过程中,电子的流动方向为电源负极→铂棒→石墨棒→电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com