
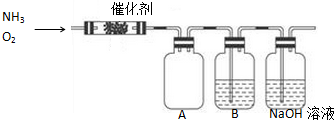
���� �Թ��з������Ĵ���������NO����װ��A��NO��һ���������������ɶ���������װ��B�ж���������ˮ��Ӧ�������ᣬ������������Һ���յ����������ֹ��Ⱦ������
��1��װ��B�ж���������ˮ��Ӧ�������ᣬ������������Һ���յ��������
��2������������ˮ��Ӧ�����������ƺ�������
��3����ӦΪ���ȷ�Ӧ���ų��������ȣ�700��ʱˮ�����壻
��4���١�H=��Ӧ��ļ��ܺ�-������ļ��ܺͣ�
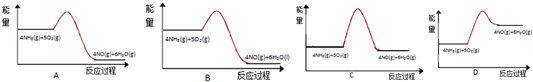
�ڶ��������ֽ������ȷ�Ӧ��
��5���ٰ����������ܷ�Ӧ��������泥�
�ڸ��ݷ�Ӧ����ʽ�а�����������ϵ�жϣ�
��� �⣺��1��װ��B�ж���������ˮ��Ӧ�������ᣬ������������Һ���յ����������ֹ��Ⱦ�������ʴ�Ϊ��ˮ������β����
��2������������ˮ��Ӧ�����������ƺ���������ѧ����ʽΪ2Na2O2+2H2O=4NaOH+O2�����ʴ�Ϊ��2Na2O2+2H2O=4NaOH+O2����
��3����ӦΪ���ȷ�Ӧ���ų��������ȣ���Ӧ�������������������������ߣ�700��ʱˮ�����壬�ʴ�Ϊ��A��
��4���١�H=��Ӧ��ļ��ܺ�-������ļ��ܺ�=931kJ/mol��2-628kJ/mol��2-493kJ/mol=+113kJ/mol���ʴ�Ϊ��+113kJ/mol��
�ڶ��������ֽ������ȷ�Ӧ�������¶ȣ������ڷֽ⣬�ʴ�Ϊ��2NO2��g��?2NO��g��+O2��g����H��0�������¶ȣ�ƽ�������ƶ���������NO2�ķֽ⣬�����������NO2��
��5����һ��������������Ӧ���ɶ�������������������ˮ��Ӧ�������ᣬ�����������ܷ�Ӧ��������泥���ѧ����ʽ��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��NH3+HNO3=NH4NO3���ʴ�Ϊ��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��NH3+HNO3=NH4NO3��
����4NH3+5O2$\frac{\underline{\;\;����\;\;}}{���¸�ѹ}$4NO+6H2O��4NO+3O2+2H2O=4HNO3�ɵã�NH3+2O2=HNO3+H2O����ԭ�ϰ������������ʵ�����Ͷ�ϱ�Ϊ1��2���ʴ�Ϊ��1��2��
���� ���⿼��ʵ���Ʊ����Ȼ�ѧ����ʽ���㡢������ԭ��Ӧ�ȣ�ʵ��ƴ������Ŀ����ȷ��Ϸ�Ӧԭ����ȷ��װ�õ����ã��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������⣨H2O2���ǵ���ɫ����Һ�壬ˮ��ҺΪ��ɫ��Һ�壬�׳�˫��ˮ�����Կ�����Ԫ���ᣮ
�������⣨H2O2���ǵ���ɫ����Һ�壬ˮ��ҺΪ��ɫ��Һ�壬�׳�˫��ˮ�����Կ�����Ԫ���ᣮ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ� | B�� | �ȼ��� | C�� | ������ | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
��֪��  | |
���裺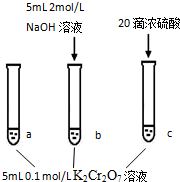 | ���� ���Թ�b����ɫ��������Թ�a�Ƚϣ���Һ��ɫ��dz�� �μ�Ũ���ᣬ�Թ�c�¶��������ߣ���Һ��ɫ���Թ�a��ȣ���� |
| A�� | �÷�Ӧ��һ��������ԭ��Ӧ | |
| B�� | ���Թ�b����Һ��ɫ�����Ŀ����ʹCr2O72-��ȫ��Ӧ | |
| C�� | ��ʵ�鲻��֤����С������Ũ�ȣ�ƽ�������ƶ� | |
| D�� | �Թ�c�е�����˵��Ӱ��ƽ�����Ҫ�������¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ��������g/mol | B�� | ����Ħ�������mol/L | ||
| C�� | �ܽ�ȣ�g/100gH2O | D�� | �ܶȣ�g/cm3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ܢݢ� | C�� | �٢ۢ� | D�� | �ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ������Ͷ��ǿ�������Դ������Ҫ������չ���Ҵ����͡� | |
| B�� | ����ϩ��������Է����ӳɡ�ˮ���������Ӧ | |
| C�� | ���ͱ�����Ļ����1mol����ȫȼ������O2�ķ�����Ϊ7.5NA | |
| D�� | �ұ��ܱ�����KMnO4��Һ����������Ϊ�����Բ����ϵ�-CH2-������Ӱ�죬ʹ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol•L-1Na2CO3��Һ�У�c��OH��-=c��H+��+c��HCO3-��+c��H2CO3�� | |
| B�� | ��ͬ���ʵ���Ũ�ȵ�NaCN��NaClO��ȣ�NaCN��Һ��pH�ϴ������ͬ�¡�ͬ�����ͬpH��HCN��HClO�ֱ���Na0Hǡ����ȫ��Ӧʱ������NaOH�����ʵ�����HClO��HCN | |
| C�� | ���������Һ�м����������ᣬ�õ����ԵĻ����Һ��c��Na+����c��CH3COO-����C��H+����c��OH-�� | |
| D�� | ����������Һ�еμ�ϡ����õ�pH=5�Ļ����Һ��c��Na+��=c��NO3-��+c��Cl-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com