
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是 .
.分析 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增,B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为C元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,为Mg元素;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,则F为Cl元素;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3,据此进行解答.
解答 解:A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增,B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为C元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,为Mg元素;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,则F为Cl元素;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3,
(1)C单质为N2,分子中N原子之间形成3对共用电子对,电子式为 ,F为Cl元素,Cl-的电子排布式为1s22s22p63s23p6,E为Mg元素,原子结构示意图是
,F为Cl元素,Cl-的电子排布式为1s22s22p63s23p6,E为Mg元素,原子结构示意图是 ,
,
故答案为: ;1s22s22p63s23p6;
;1s22s22p63s23p6; ;
;
(2)化合物乙为NH4NO3,含有的化学键有:离子键、共价键、配位键,
故答案为:离子键、共价键、配位键;
(3)化合物甲为CO2,二氧化碳为共价化合物,其分子式为 ;Mg在二氧化碳燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
;Mg在二氧化碳燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为: ;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)ABC分子为HCN,分子中的三个原子除H原子外均为8电子构型,该分子的结构式为:H-C≡N,根据电子云重叠方式的不同,分子里共价键的类型有:σ键、π键,
故答案为:H-C≡N;σ键、π键;
(5)常温下,NH3呈气态,但易被液化,且极易溶于水,其原因是:NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水,
故答案为:NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水;
(6)液态的NH3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,Na与液态NH3反应的化学方程式为:2Na+2NH3=2NaNH2+H2↑,
故答案为:2Na+2NH3=2NaNH2+H2↑.
点评 本题考查原子结构与元素周期律的综合应用,题目难度中等,推断元素是解题关键,试题侧重对化学用语的考查,有利于基础知识的巩固,注意氢键对物质性质的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应是吸热还是放热的,须看反应物和生成物所具有总能量的大小 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 需要加热方能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体通入硝酸钡溶液,生成白色BaSO4沉淀 | |
| B. | 氨气的水溶液可以导电,所以氨气是电解质 | |
| C. | 酸性高锰酸钾溶液中通入二氧化硫气体,溶液褪色,证明二氧化硫有漂白性 | |
| D. | 硝酸具有挥发性,所以硝酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
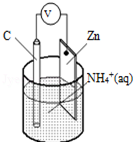 酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的负极 | B. | 氨气在碳棒上生成 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 46g乙醇中含有C-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

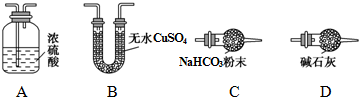
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com