
| A. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| B. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| C. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
分析 A.无色酚酞遇碱液变红色;
B.将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝;
C.次氯酸具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,次氯酸有漂白性.
解答 解:A.无色酚酞遇碱变红色,向Na2SiO3溶液中滴加酚酞,溶液变红,说明该溶液呈碱性,则硅酸钠水解导致溶液呈碱性,故A正确;
B.氧化铝的熔点高于铝的熔点,铝表面被一层致密的氧化铝包着,所以铝箔在酒精灯火焰上加热熔化但不滴落,故B正确;
C.次氯酸具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和盐酸,故C错误;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,则氯水中加入蓝色石蕊试纸变红色,次氯酸有漂白性,所以试纸最后褪色,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、次氯酸的漂白性、盐类水解等知识点,易错选项是C,注意次氯酸漂白性具有永久性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
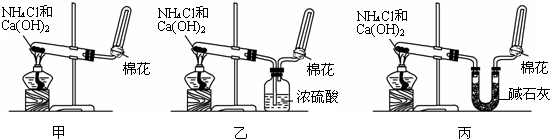
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{NaOH溶液}{→}$Al2O3 | |
| B. | N2$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{O_{2}、H_{2}O}{→}$HNO3 | |
| C. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的K0H、Cl2和H2都是电解质 | |
| B. | 反应②属于离子反应 | |
| C. | 若反应①消耗7.45gKCl,可以制备标准状况下4.48L氯气 | |
| D. | 反应②中氧化剂和还原剂的质量之比是1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com