
| 催化剂 |
| △ |

 ,根据电子式可以书写结构简式为:H2C=CH2,
,根据电子式可以书写结构简式为:H2C=CH2, ;H2C=CH2;
;H2C=CH2;| Cu或Ag |
| △ |
 ,属于加聚反应,
,属于加聚反应,| Cu或Ag |
| △ |
 ;加聚反应.
;加聚反应.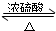 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,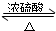 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;

科目:高中化学 来源: 题型:
| 物质 | NaCl | NaBr | NaI | AlCl3 | KCl | RbCl | CsCl | CCl4 |
| 熔点(℃) | 801 | 747 | 660 | 194 | 711 | x | 646 | -22.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、一定有Cl- |
| B、一定有CO32- |
| C、一定没有K+ |
| D、一定没有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊 | BaCl2溶液 |
| B | 通入CO2,溶液不变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,向2L容积不变的密闭容器中加入一定量的N2、H2和NH3三种气体,发生反应:2NH3(g)?N2(g)+3H2(g)(△H>0),各物质的浓度随时间的变化如图1所示.图2为t2时刻后改变容器内的某一条件,反应速率(v)随时间(t)的变化情况.下列叙述正确的是( )
一定条件下,向2L容积不变的密闭容器中加入一定量的N2、H2和NH3三种气体,发生反应:2NH3(g)?N2(g)+3H2(g)(△H>0),各物质的浓度随时间的变化如图1所示.图2为t2时刻后改变容器内的某一条件,反应速率(v)随时间(t)的变化情况.下列叙述正确的是( )| A、若容器内气体的密度不再发生变化,则说明反应达到平衡状态 |
| B、若t1=20 s,则从t0~t1内的平均反应速率v(NH3)=0.01 mol?L-1?s-1 |
| C、图2中,t2时改变的条件是降低温度,t3时改变的条件是增大压强 |
| D、若t2时,再向容器中加入1.4 mol NH3、0.8 mol H2,则平衡将正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3- |
| C、一定温度下,1L0.5mol?L-1NH4Cl溶液中与2L0.25mol?L-1NH4Cl溶液含NH4+物质的量相同 |
| D、常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+可能大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com