
| A、向已经变质的FeCl2溶液中滴加KSCN溶液,溶液变红,则说明FeCl2已完全变质 |
| B、向某一无色气体中通入氧气,气体变红棕色,则证明有NO |
| C、可用PH试纸来测浓硫酸的PH值 |
| D、取某溶液,先后滴入氯化钡溶液和稀硝酸,产生白色沉淀,则该溶液中一定含有SO42- |


科目:高中化学 来源: 题型:
| A、质子数:b>C |
| B、原子半径:r(A)>r(D) |
| C、离子的还原性:C2->D- |
| D、离子半径:r(B2+)>r(C2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红棕色NO2加压后颜色先变深后变浅 |
| B、实验室中常用排饱和食盐水的方法收集氯气 |
| C、SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 |
| D、压缩H2与I2(g)反应的平衡混合气体,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
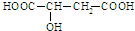 .下列有关苹果酸的说法不正确的是( )
.下列有关苹果酸的说法不正确的是( )| A、1mol苹果酸足量金属钠反应,生成氢气3g |
| B、1mol苹果酸与足量氢氧化钠溶液反应,消耗3mol氢氧化钠 |
| C、1mol苹果酸能与足量的碳酸氢钠溶液反应,标况下生成44.8L的二氧化碳气体 |
| D、苹果酸在一定条件下既能与醋酸反应,又能与乙醇反应,也可以自身发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粒子半径:Al3+>Mg2+>Na+>F- |
| B、稳定性:HI<HBr<HCl<HF |
| C、酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| D、碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,向0.1mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
| B、25℃时,NaB溶液的pH=8,c(Na+)+c(B-)=9.9×10-7mol?L-1 |
| C、0.1mol?L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| D、同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
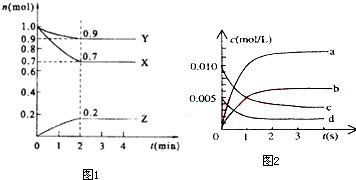
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.
随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.| 物 质 | CO2 | H2 | CH3OH(g) | H2O(g) |
| 起始浓度(mol/L) | 1.0 | 3.0 | 0 | 0 |
| 10min末浓度(mol/L) | 0.75 | 0.75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com