
答案 AB
解析 水分子中各原子已达到稳定结构,H3O+是H+和H2O中的O形成配位键;[B(OH)4]-是3个OH-与B原子形成3个共价键,还有1个OH-的O与B形成配位键;其他项均不能形成配位键。
★ ★★
答案 Ⅰ.(1)N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键
(2)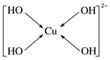 或
或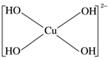
(3)D
Ⅱ.(1)[Fe(SCN)]2+
(2)FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
解析 Ⅰ.(1)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N原子,而在NF3中,共用电子对偏向F原子,偏离N原子。
(2)Cu2+中存在空轨道,而OH-中O原子有孤对电子,故O与Cu之间以配位键结合。
(3)A项,与S相连的氧原子没有杂化;B项,氢键不是化学键;C项,Cu2+的价电子排布式为3d9;D项,由图可知,胆矾中有1个H2O与其他微粒靠氢键结合,易失去,有4个H2O
与Cu2+以配位键结合,较难失去。
★ ★★


科目:高中化学 来源: 题型:
储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
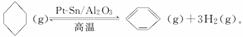 在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,按熔点由低到高排列的是( )
A.O2、I2、Hg B.CO2、Al2O3、KCl
C.Na、K、Rb D.H2S、H2Se、H2Te
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各组气体中,试分析判断哪种气体更易液化。
①Cl2、N2 ②SiH4、CH4 ③SO2、CO2 ④邻二甲苯、对二甲苯 ⑤甲烷、乙烷 ⑥丁烷、异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键;分子间作用力;极性键
B.氢键;氢键;非极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.16 g B.32 g
C.64 g D.无法计算
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com