
分析 (1)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(2)NH3含有氢键,沸点升高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高;非金属性越强,气态氢化物越稳定;
(3)首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型;
(4)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形;
(5)F元素电负性很大,分子之间形成氢键,以形成缔合分子;
(6)酸和碱反应生成盐和水,H3PO3为二元酸,与过量的NaOH溶液反应生成盐为Na2HPO3;
(7)当中心原子有空轨道,配离子含有孤对电子时,能形成配位键;
(8)一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答 解:(1)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高,
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(2)NH3含有氢键,沸点较高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高,故熔沸点:NH3>AsH3>PH3,所以沸点最低的是PH3,同主族从上到下非金属性减弱,气态氢化物稳定性逐渐减弱,所以稳定性最强的是NH3,
故答案为:PH3;NH3;
(3)SnBr2分子中,Sn原子的价层电子对数目是$\frac{(4+2)}{2}$=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,
故答案为:<;
(4)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
(5)F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n,实验测得HF的相对分子质量一般高于理论值,
故答案为:F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n;
(6)酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚磷酸和过量氢氧化钠的反应方程式为:H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:H3PO3+2NaOH=Na2HPO3+2H2O;
(7)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,
故答案为:配位键;CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(8)H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:大;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
点评 本题考查物质结构与性质,明确杂化、氢键、电负性、配位键等知识是解答关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 冰晶石能降低Al2O3的熔点,用Al2O3炼铝时加入它可减少能耗 | |
| B. | Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 | |
| C. | 氧化钠能与H2O、CO2反应,可用作漂白剂和供氧剂 | |
| D. | 常温时浓硝酸与铁不反应,可用铁桶贮存浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
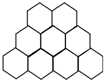 石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )
石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )| A. | 3:2 | B. | 2:1 | C. | 1:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
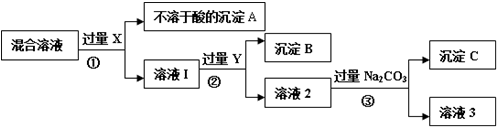
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
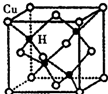 (1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
(1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液可能存在K+、SO42- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液肯定只存在NH4+、SO32- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com