
分析 浓硫酸具有吸水性,增重10.8g为水的质量,氢氧化钠溶液增重22g为二氧化碳的质量,根据n=$\frac{m}{M}$计算生成水、二氧化碳物质的量,再根据原子守恒计算烃分子中C原子、H原子数目,进而确定烃的分子式;先利用减链法书写同分异构体,然后根据一氯取代物的种类等于氢原子的种类写出结构简式.
解答 解:(1)浓硫酸具有吸水性,增重7.2g为水的质量,则生成水的物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,则n(H)=2n(H2O)=1.2mol;
答:0.1mol某烃中氢原子的物质的量为1.2mol;
(2)氢氧化钠溶液增重22g为二氧化碳的质量,生成二氧化碳物质的量为=$\frac{22g}{44g/mol}$=0.5mol,则n(C)=n(CO2)=0.5mol;
答:0.1mol某烃中碳原子的物质的量为0.5mol;
(3)根据原子守恒,烃分子中C原子数目为$\frac{0.5mol}{0.1mol}$=5、H原子数目为$\frac{1.2mol}{0.1mol}$=12,则烃的分子式为C5H12,
答:烃的分子式为C5H12;
(4)所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;
拿下1个碳原子作为支链: ;
;
拿下2个碳原子作为支链: ;
;
其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,即为 ;
;
答:该烃的结构简式为 .
.
点评 本题考查有机物分子式确定,比较基础,掌握燃烧法利用原子守恒确定有机物分子式,注意把握同分异构体的书写方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
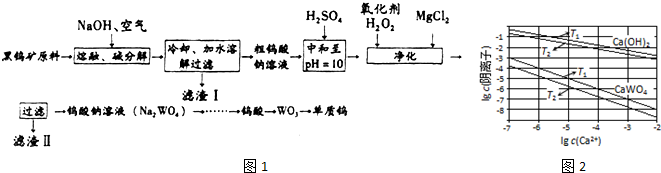
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
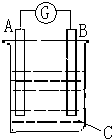 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、SO42-、Cl-不能大量共存,只是因为:Mg2++SO42-═MgSO4↓ | |
| B. | H+、Fe2+、NO3-ClO-不能大量共存,只是因为:H++ClO-═HClO | |
| C. | K+、Ca2+、SiO32-、Cl-不能大量共存,只是因为:Ca2++SiO32-═CaSiO3↓ | |
| D. | Fe3+、NH4+、HCO3-、SCN-不能大量共存,这是因为:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )
六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )| A. | 简单离子半径大小:Q>Y>X | |
| B. | 最简单气态氢化物的沸点高低:Y>Z | |
| C. | Q的最高价氧化物可与X的氢化物直接反应 | |
| D. | X与Y既可存在于同一共价化合物中,也可存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
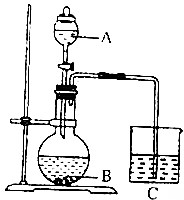 某化学小组设计如图装置完成一组实验;
某化学小组设计如图装置完成一组实验;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com