
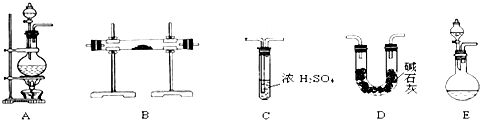
分析 (1)方案1制备氮气,为液体加热制备气体,据此选择发生装置;
(2)若以方案2制得干燥、纯净的N2,用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置E符合条件,利用碱石灰干燥氨气,干燥的氨气与CuO在B装置中反应得到氮气,利用浓硫酸吸收未反应的氨气及反应生成的水;
由题目信息可知,氨气与氧化铜在加热条件下反应生成Cu、氮气,根据元素守恒,还有水生成.
解答 解:(1)方案1制备氮气,为液体加热制备气体,题目提供的发生装置中A符合,故选:A;
(2)若以方案2制得干燥、纯净的N2,用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置E符合条件,利用碱石灰干燥氨气,干燥的氨气与CuO在B装置中反应得到氮气,利用浓硫酸吸收未反应的氨气及反应生成的水,故整套制气装置按气流从左到右的连接顺序是:E→D→B→C;
由题目信息可知,氨气与氧化铜在加热条件下反应生成Cu、氮气,根据元素守恒,还有水生成,获得N2的反应原理是:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
故答案为:E→D→B→C;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
点评 本题考查化学实验方案设计,设计制备原理、干燥净化、装置选择,明确制备流程为解题关键,是对学生综合能力的考查,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 最高第二周期元素从左到右,正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题
实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min末时A和B的浓度之比为5:3 | |
| B. | x=1 | |
| C. | 2 min末时B的浓度为1.5 mol•L-1 | |
| D. | 前2 min,A的消耗浓度为0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.
在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
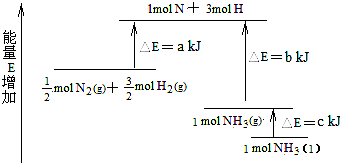
| A. | N2(g)+H2(g)=NH3(l)△H=+(b+c-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=+2(b-a)kJ•mol-1 | |
| C. | N2(g)+3H2(g)=2NH3(l)△H=-2(b+c-a)kJ•mol-1 | |
| D. | N2(g)+H2(g)=NH3(g)△H=+(a+b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S | B. | C | C. | Cl | D. | F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com