

分析 (1)根据原子守恒可以得而X的化学式,存在元素的化合价改变的反应为氧化还原反应;
(2)则根据元素守恒得:FeTiO3~TiO2,根据FeTiO3的质量1t×76%×92%×96%,来计算二氧化钛的质量;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
(3)从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;从溶液中得到晶体的操作为结晶后过滤;铁粉与可能生成的+3价的铁反应生成+2价的铁;
(4)根据水解原理:TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-来书写方程式;
(5)因SO2、SO3是酸性氧化物,可以和碱液之间反应,据此回答.
解答 解:钛铁矿与硫酸反应:FeTiO3+H2SO4→TiOSO4+FeSO4+H2O,然后过滤出未被酸溶解的物质,将所得到的滤液中加入铁粉可以得到了绿矾,将滤液控制在一定的条件,让TiOSO4水解:TiOSO4+2H2O═TiO(OH)2↓+H2SO4,将过滤出的沉淀进行煅烧,可以得到钛白粉(TiO2).
(1)根据原子守恒可以得而X的化学式为FeSO4,在FeTiO3中Ti为+4价故Fe为+2价,反应后铁元素的化合价没有发生改变,钛元素化合价也没有发生改变,其他元素的化合价都没发生改变,故此反应为非氧化还原反应.
故答案为:FeSO4;氧化还原反应;
(2)设得到二氧化钛的质量是m,则根据元素守恒得:
FeTiO3~TiO2
152 80
1t×76%×92%×96% m
m=0.35t,在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
故答案为:0.35;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
(3)在操作I从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;在操作II加入铁粉后得到了绿矾,故应是从溶液中得到晶体的操作为结晶后过滤;在操作II加入铁粉的目的是为了防止在制备过程中钛铁矿+2价的铁生成+3价的铁使制备的绿矾中含有杂质,故应加入铁粉与可能生成的+3价的铁反应生成+2价的铁,
故答案为:过滤;过滤;Fe+2Fe3+═3Fe2+;
(4)TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-,故反应为:TiOSO4+2H2O═TiO(OH)2↓+H2SO4,
故答案为:TiOSO4+2H2O═TiO(OH)2↓+H2SO4;
(5)因SO2、SO3是酸性氧化物,故应用碱液进行吸收,故答案为:用碱液吸收.
点评 本题考查物质的制备实验方案的设计,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,为高考常见题型,明确制备流程及反应原理为解答关键,注意把握实验的基本原理和常见物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:推断题
[化学——选修5:有机化学基础]抗疟新药青蒿素的结构简式如下图所示。
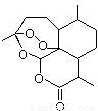
(1)青蒿素的分子式为____。
(2)为了引入过氧基(-O-O-),需要在有机合成中引入羟基,引入羟基的反应类型有____。(选填编号)
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤还原反应
天然香草醛(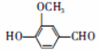 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图:
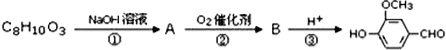
(3)M的结构简式为____。
(4)步骤①③的作用是____。
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的结构简式____。
①苯环二取代;②能水解;③能发生银镜反应;④与FeCl3溶液发生显色反应。
(6)苄基乙醛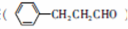 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
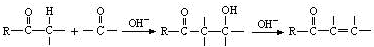
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
H2S水溶液中存在电离平衡H2S ?H++HS-和HS-
?H++HS-和HS- ?H++S2-。若向H2S溶液
?H++S2-。若向H2S溶液
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
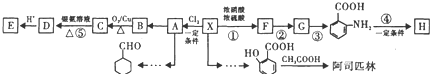
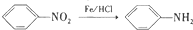 (苯胺、易被氧化)
(苯胺、易被氧化)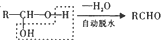
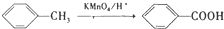
 ;
;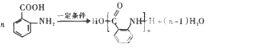 ;
;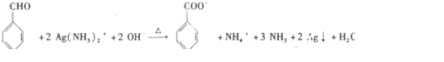 .
.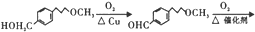 完成
完成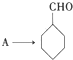 的流程图
的流程图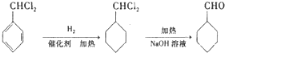 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
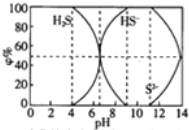
| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com