
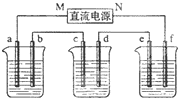
 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:

 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:W>Z>Y>X |
| B、含Y元素的盐溶液一定显酸性 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
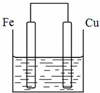 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、③ | C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②⑤⑥ |
| C、②⑤ | D、①⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com