
| 1000g |
| 4g |


 能考试期末冲刺卷系列答案
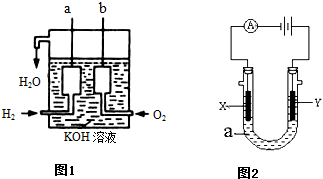
能考试期末冲刺卷系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
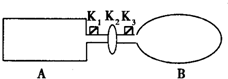
科目:高中化学 来源:不详 题型:单选题
| A.向左移动 | B.向右移动 | C.不移动 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.升高温度,正向反应速率减小,逆向反应速率增加 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.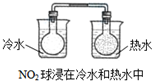 | ||||||||
B.
| ||||||||
C.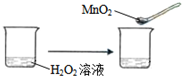 | ||||||||
D.
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙提高相同温度 |
| B.甲中加入0.1molHe,乙不变 |
| C.甲降低温度,乙不变 |
| D.甲增加0.1molH2,乙增加0.1molI2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
| A.A | B.B | C.C | D.D |
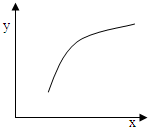
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加压有利于SO2与O2反应生成S03 |
| B.500℃左右比常温下更有利于合成氨 |
| C.将混合气中的氨气液化,有利于合成氨的反应 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH=Na++OH一 | B.CuSO4=Cu2++SO42- |
| C.Na2CO3=Na++CO32- | D.H2SO4=2H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com