
【题目】(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= ;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为 。
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为 。
【答案】(1)3 bcf (2)< (3)H2A![]() H++HA-(4)9∶1
H++HA-(4)9∶1
【解析】
试题分析:(1)根据c(H+)=c(HAc)×ɑ,则c(H+)=0.1×1%,pH=3;醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+。a、加入盐酸增大了溶液c(H+),对醋酸的电离起抑制作用,a错误;b、弱电解质的电离是吸热反应,加热,有利用向电离反应方向进行,b正确;c、加水稀释,降低了浓度,根据勒夏特列原理,平衡向浓度增大的方向进行,即向电离反应进行,c正确;d、加入冰醋酸,电离程度降低,d错误;e、加入氯化钠固体,对电离无影响,e错误;f、加入氢氧化钠,消耗H+,促使平衡向电离方向进行,f正确。答案选bcf;
CH3COO-+H+。a、加入盐酸增大了溶液c(H+),对醋酸的电离起抑制作用,a错误;b、弱电解质的电离是吸热反应,加热,有利用向电离反应方向进行,b正确;c、加水稀释,降低了浓度,根据勒夏特列原理,平衡向浓度增大的方向进行,即向电离反应进行,c正确;d、加入冰醋酸,电离程度降低,d错误;e、加入氯化钠固体,对电离无影响,e错误;f、加入氢氧化钠,消耗H+,促使平衡向电离方向进行,f正确。答案选bcf;
(2)盐酸是强酸,醋酸是弱酸,相同pH时,弱酸的浓度大于强酸,则盐酸的物质的量小于醋酸,反应后只有一种溶液中有锌剩余,此溶液是盐酸,即产生氢气的体积V(盐酸) <V(醋酸);
(3)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,第一步电离方程式为:H2A![]() H++HA-;
H++HA-;
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则盐酸过量,则有:c(H+)混=![]() =
=![]() =10-6,则NaOH溶液与盐酸溶液的体积比为9∶1。
=10-6,则NaOH溶液与盐酸溶液的体积比为9∶1。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
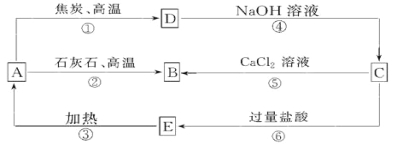
请回答:
(1)写出对应物质的化学式:A__________; C__________; E__________。
(2)反应①的化学方程式为: 。
(3)反应④的离子方程式为: 。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明: _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )。
A. CO32—、Cl— B. NO3—、Cl—
C. NO3—、SO42— D. OH—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不能减少大气污染的是
A.大力发展清洁能源,烟气脱硫
B.大力发展私家车,减少公共交通
C.利用太阳能、风能等替代化石能源
D.提倡多使用自行车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关H2SO4的叙述正确的是( )
A.H2SO4的相对分子质量是98g/mol
B.1molH2SO4的质量是98g
C.1molH2SO4中含有1molH2
D.1molH2SO4中共含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是
A. 各常数的大小与温度有关 B. 各常数的大小说明平衡体系正反应的程度大小
C. 若温度升高则各常数一定增大 D. 各常数越大反应物平衡转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写方程式
(1)用铝箔包一小块钠放入足量水中,写出有关反应的离子方程式: ;
(2)实验室制氢氧化铝的离子方程式: ;
(3)氢氧化亚铁在空气中变为红褐色的化学方程式: ;
(4)生成四氧化三铁的置换反应的化学方程式: ;
(5)写出氯化铁溶液腐蚀由高分子材料铜箔复合而成的印刷电路板的化学方程式: ;
(6)写出过氧化钠用于呼吸面具或潜水艇中氧气来源涉及的化学方程式: ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com